4. osztály - Fizika
4. Az atommag kvantum elmélete
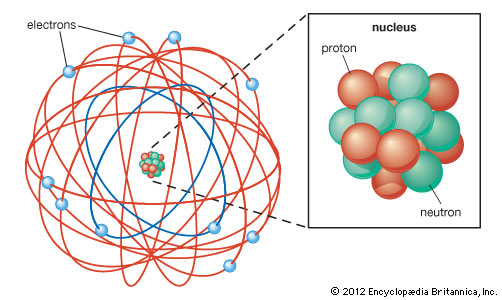
Rutherford-féle atommodell
Rutherford már 1906-ban észrevette, hogy az α-részecskék irányváltoztatás nélkül áthaladnak vékony fémfóliákon, de néhány közülük jelentősen eltérül. Ezek az első eredmények azt sugallták számára, hogy az anyag nem tömör, az atom belsejében egy erősen pozitív töltésű magnak kell lennie. Ez a mag képes eltéríteni az α -részecskéket, de csak akkor, ha azok elegendően közel haladnak el mellette.
A Rutherford-féle α-szórási kísérletből a következőket állapították meg:
- az atommag pozitív töltésű (az azonos töltések taszításának következménye az eltérülés);
- az atommag töltése függ a rendszámtól (ez a különböző anyagokkal végzett kísérletekből adódott;
- az atommag mérete legfeljebb (visszaszóráskor az α-részecske egy pillanatra megáll, kezdeti mozgási energiájából kiszámítható, hogy mennyire közelítette meg a magot, ennél az atommag csak kisebb lehet).
Az alfa-szórási kísérletből leszűrt megállapítások alapján Rutherford olyan atommodellt javasolt, amelyben a központi atommag körül keringenek az elektronok. Az elképzelés hasonlít a Naprendszerhez, ahol a bolygók a Nap körül keringenek. Ezt az atommodellt nevezzük bolygómodellnek. Rutherford modelljében az elektronokat az atommag elektromos vonzása tartja a mag körül.
Az atommag körül keringő elektronok a klasszikus fizika törvényei szerint energiájukat nagyon rövid idő alatt kisugároznák, mint egy antenna a rádióadást, ezért be kellene zuhanniuk a pozitív töltésű magba. A tapasztalat azt mutatta, hogy ez nem történik meg, tehát a Rutherford-féle atommodell ellentmond a klasszikus fizika törvényeinek. Rutherford és munkatársai következtetése ennek ellenére korszakalkotó volt, mert új lendületet adott az atomszerkezet vizsgálatához.
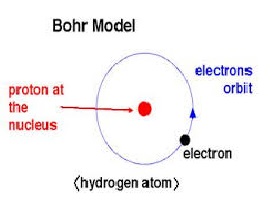
A tananyaghoz fűződő videófelvételBohr-féle atommodell
Nils Bohr (1885-1962) dán fizikus felismerte a Rutherford-féle atommodell hiányosságait, miszerint ha az elektronok tetszőleges pályán mozoghatnának, akkor semmi sem akadályozná meg, hogy folyamatos energiaveszteség közben mind jobban meg ne közelítsék az atommagot, amelybe végül belezuhannának. A Rutherford-féle atom tehát nem lehetne stabil, ezért folyamatos energia-kisugárzást kellene észlelni.
A Bohr-féle atommodell alapján értelmezhetők az atommag kibocsátási és elnyelési színképei. A Bohr-féle atommodell helyességét a H színkép vonalai bizonyították, ugyanis az ebben megjelenő színkép-vonalak energiája pontosan megegyezett a Bohr-féle atommodellből kiszámított atompályák energiakülönbségeivel.
Sommerfield kiegészítette a Bohr-féle atommodellt, azzal, hogy az elektronok az atommag körül nem csak kör alakú, hanem ellipszis alakú atompályán is mozoghatnak. Azt fejezte ki, hogy: vesszük n = 2 energiaszintet. Ehhez tartozik egy kör alakú és egy ellipszis alakú atompálya is.
- Az elektron az atomban nem lehet akárhol, hanem csak meghatározott távolságokban, kör alakú pályákon ún. elektronhéjakon keringhet a mag körül.
- Az elektron csak meghatározott nagyságú energiát vehet fel, csakis akkorát, hogy azzal egy másik, magasabb energiájú pályára jusson. A gerjesztett állapotú atom energiát sugároz ki, ami után ismét alapállapotba kerül. A kisugárzott energia nagysága azonos a gerjesztés során felvettével. Ebből következik, hogy minden pályához csak egy adott energiaszint tartozhat.