4. razred - Fizika
4. Kvantna teorija atoma
Raderfordov eksperiment
U početku se bavio proučavanjem radioaktivnih raspada. Prvi je uočio da se zračenje radijuma sastoji od tri vrste, koje je nazvao α-, β- i γ-zračenje. Zajedno sa Sodijem uveo je pojam vreme poluraspada i formulisao zakone radioaktivnog raspada. Proučavanjem raspadanja α-čestica na atomima Raderford je došao do zaključka da atom nije kompaktan delić materije, već se sastoji od pozitivnog jezgra (radijusa 10-12cm) i elektrona koji kruže oko njega.
Kada se metalna folija bombarduje α-česticama, jedan deo pozitivno naelektrisanih čestica u sudaru sa pozitivnim naelektrisanjem atoma skreće sa prvobitne putanje, dakle rasejava se, dok drugi veći deo ipak prolazi kroz foliju. Međutim, poneka čestica skrene za neočekivano veliki ugao (kao da se odbije od folije). Raderford je ovo opažanje njegovih đaka Gajgera i Marsdena prokomentarisao rečima: "Bio je to najneverovatniji događaj u mom zivotu. To je isto tako neverovatno kao kada biste na list papira ispalili topovsko zrno prečnika 15" (38cm), a ono se od njega odbije i pogodi vas." Analizirajući ovaj problem, Raderford je zaključio da su celokupna masa i pozitivno naelektrisanje atoma skoncentrisani u vrlo malom prostoru, dakle da postoji jezgro atoma. Tako je nastao Planetaran model atoma.
Raderfordov model nije mogao da objasni stabilnost atoma i linijski karakter spektara, jer prema klasičnoj fizici, ubrzano kretanje elektrona oko jezgra znači i stalnu emisiju energije u obliku elektromagnetnih talasa (kontinualni spektar) i stalno smanjenje radijusa putanje.
Raderford je prvi upotrebio reč proton za pozitivno naelektisanu česticu u jezgru atoma. Od njega potiče i formula za rasejanje α-čestica na jezgrima atoma. Godine 1925. Raderford je utvrdio i odstupanje od te formule, do kojeg dolazi kod vrlo bliskih sudara α-čestice i jezgra, kad nuklearno međudelovanje postaje mnogo važnije od električnog. Godine 1919. Raderford je, bombardujući azot α-česticama, izveo prvu transmutaciju jednog elementa u drugi – iz azota je uspeo da dobije kiseonik. Ovo je prikazano sledećom reakcijom:
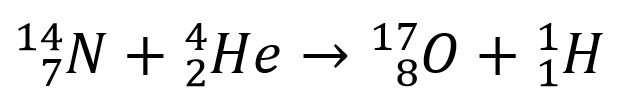
Reakcija se piše u skraćenom obliku na sledeći način:
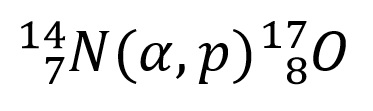
i smatra se prvom nuklearnom reakcijom.
Jedan krater na Mesecu nosi Raderfordovo ime, kao i nova zgrada Kevendišove laboratorije u Kembridžu, a na novčanici od 100 novozelandskih dolara nalazi se njegov lik. Takođe, veštački hemijski element raderfordijum (atomski broj 104) od 1997. godine po njemu nosi ime.
Raderfordov eksperiment
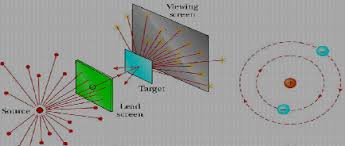
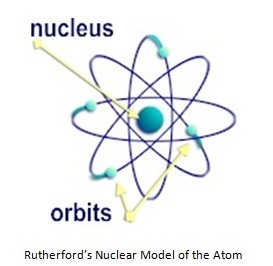
Raderford je 1911 godine uradio eksperiment koji je dao odlučujući doprinos formiranju modela strukture atoma. Iz radioaktivnog izvora koji je smešten u olovnoj kaseti, snop α-čestica se usmerava ka tankom listiću od zlata. Posle prolaska kroz listić snop i rasejane α-čestice izazivaju svetlucanje na fluorescentnom zaklonu.
Najveći broj α-čestica iz snopa stiže do ekrana bez skretanja ili skreće pod vrlo malim uglom. Tek poneka čestica se vrati unazad.
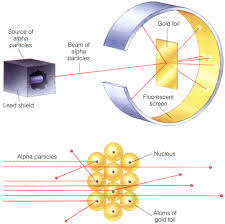
Zaključci na osnovu rezultata:
- ako najveći broj α-čestica prolazi bez skretanja kroz listić zlata onda je najveći deo prostora koji atom zauzima prazan;
- kako veoma mali broj α-čestica skreće sa pravca kretanja po prolasku kroz listić, a još manji broj se kraće unazad, najverovatnije da su celokupna masa atoma i njegovo pozitivno naelektrisanje koncentrisani u vrlo malom delu prostora koji zauzima atom.
- elektron čija je masa mnogo manja od mase α-čestice ne predstavlja prepreku prolasku α-čestice kroz atom
Na osnovu toga je pretpostavljeno: Ukupna masa atoma i njegovo pozitivno naelektrisanje nalaze se u centru atoma i koncentrisani su u veoma malom prostoru a oko tog centra se kreću elektroni.
Planetni model atoma
Kako je Raderford dokazao postojanje atomskog jezgra, ostalo je još pitanje na koji način se održava ravnoteža elektrona u električnom polju njegovog atomskog jezgra. Ovaj problem je Raderford rešio pretpostavkom da je sastav atoma sličan planetarnom Sunčevom sastavu ili da se elektroni okreću velikom brzinom oko atomskog jezgra, slično kao što se planete okreću oko Sunca. Pri tome je centrifugalna sila svakog elektrona u ravnoteži s Kulonovom elektrostatičkom silom kojom ga atomsko jezgro privlači, koja ima smer prema atomskom jezgru i deluje kao centripetalna sila. Prema tome, u Raderfordovom modelu atoma atomi se održavaju dinamičkom ravnotežom. Prema ovom viđenju iz 1911., atom se sastoji od atomskog jezgra i elektronskog omotača koji čine elektroni, a između njih se nalazi praznina, u kojoj deluju električna i magnetna polja.
Raderfordov model atoma je napravio veliki napredak u nuklearnoj fizici, ali će on kasnije biti dopunjen s Borovim modelom atoma.
Elektroni kruže oko jezgra i posle nekog vremena (10-10s) trebalo bi da upadnu u jezgro (zbog gubitka energije usled zračenja i prema predvidjanju klasične fizike), ali se to ne dogadja. Odgovor daje kvantna fizika (fizika kojom se opisuje mikro svet) a suština je u postojanju stacionarnih stanja.
Elektroni se u atomima nalaze u posebnim stacionarnim stanjima, kojima odgovaraju strogo određene energije, energijiski nivoi, koji se ne menjaju bez spoljašnjih uticaja. Dok se elektron nalazi u stacionarnim stanjima atom ne emituje niti apsorbuje elektromagnetno zračenje (prvi Borov postulat).
Video u vezi ovog poglavljaBorov model atoma
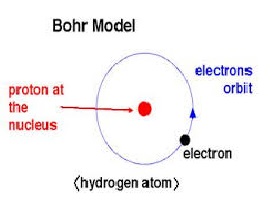
Borov model atoma predstavlja atom sa malim pozitivno naelektrisanim jezgrom oko kojeg se elektroni kreću u kružnim orbitama slično kretanju planeta oko Sunca. Dakle, po Borovom modelu atom je sličan planetarnom sistemu s tom razlikom što privlačna sila potiče od elektrostatičke interakcije a ne od gravitacije. Glavni uspeh modela, koji je predložio Nils Bor 1913. godine, je objašnjenje Ridbergove formule za spektralne emisione linije atomskog vodonika. Ridbergova formula je eksperimentalno od ranije bila poznata ali je tek Borovim modelom bila kvantitativno teorijski objašnjena i povezana sa osnovnim osobinama atoma.
Istorija
Iz Raderfordovih eksperimenata postalo je jasno da su pozitivno naelektrisanje i masa atoma koncentrisani u centru atoma oko kojeg se nalazi difuzni oblak elektrona, nosioca negativnog naelektrisanja. Iz toga se prirodno nametnuo planetarni model atoma u kojem se elektroni kreću oko jezgra poput planeta oko sunca.
Međutim, planetarni model atoma nailazio je na brojne poteškoće u pogledu objašnjenja stabilnosti atoma i prirode atomskih spektara. Na primer, prema klasičnim zakonima elektrodinamike, naelektrisanje u kružnoj putanji mora da emituje elektromagnetno zračenje gubeći pri tome energiju. Tako bi i elektron u kružnoj orbiti oko jezgra trebalo neprekidno da emituje zračenje. Pri tome bi zbog gubitka energije njegova putanja trebalo da bude spiralni pad u atomsko jezgro, a emitovano zračenje kontinualno, jer se energija emitera neprekidno smanjuje.
Međutim još krajem 19. veka u brojnim eksperimentima sa električnim pražnjenjem u razređenim gasovima, pokazano je da atomi emituju zračenje na diskretnim, dobro definisanim fekvencijama.
Problem primene klasične elektrodinamike na atomske sisteme Bor je rešio predloživši teoriju koja je uspešno objasnila spektre jednoelektronskih atoma.
Osnovne crte teorije mogu se izložiti u obliku Borovih postulata (pretpostavki):
- Kulonova sila saopštava planetarnom elektronu centripetalno ubrzanje potrebno za dinamički stabilnu kružnu putanju.
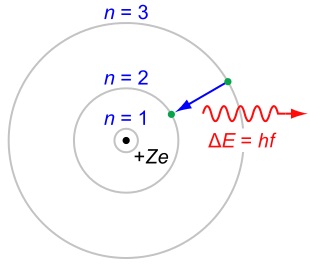
- Dozvoljene su samo one orbite kod kojih je moment impulsa, L, (ugaoni moment) elektrona celobrojni umnožak ħ gde je ħ = h/2π: L = nħ, n = 1, 2,... i h Plankova konstanta.
- Elektron koji se kreće po stabilnoj orbiti ne zrači.
- Emisija ili apsorpcija zračenja dešava se samo prilikom prelaska elektrona iz jedne orbite u drugu.
Prvim postulatom prihvaćen je planetarni model atoma kao i činjenica da su dominantne interakcije u atomu elektrostatičke prirode.
Iz drugog postulata sledi da je pored naelektrisanja i energije u atomskim sistemima kvantovan i moment impulsa.
Treći postulat odbacuje problematičnu tvrdnju da naelektrisanje u ubrzanom kretanju mora da zrači u atomskim sistemima uprkos njenoj valjanosti u makroskopskom svetu.
Četvrti postulat uspostavlja vezu sa Plankovom teorijom zračenja, pošto je frekvencija fotona koji se emituje ili apsorbuje data energijskom razlikom dva stanja podeljenom sa h.
Nedostaci
Osnovni nedostatak Borove teorije je nedoslednost. Ona pretpostavlja postojanje samo nekih mogućih stabilnih stanja atoma, odnosno, kvantnih stanja; u tim stanjima elektron ne emituje zračenje iako se kreće po kruznoj putanji. To je po klasičnoj fizici nemoguće, tj. prema Borovoj teoriji za kretanje elektrona u atomu ne važe zakoni klasične elektrodinamike. S druge strane, kretanje elektrona objašnjava se zakonima klasične mehanike.
Borova teorija je predstavljala značajnu prelaznu etapu između klasične fizike i nove kvantne teorije. Klasična teorija nije mogla da objasni niz pojava u mikrosvetu i u tom domenu je postala neupotrebljiva. Sa Plankom i Borom počeo je i razvoj kvantne mehanike – kompletnije teorije koja dobro objašnjava pojave u atomima, molekulima, kristalima.
Borov model atoma je potisnuo model valentnih ljuski. Međutim, iako je Borov model zastarela naučna teorija, zbog svoje jednostavnosti i korektnih rezultata u nekim slučajevima, on se često predaje na uvodnim kursevima kvantne mehanike.