2. osztály - Fizika
1. A kinetikus gázelmélet
A gázok tulajdonságai
Nincs térfogata, a gáz alkalmazkodik az edény alakjához és térfogatához melyben található. A gázok homogén keverékeket alkotnak függetlenül a gáz fajtájaitól és keverékek arányaitól. A gázok részecskéjei (atomok és molekulák) a tér 0,1% foglalják el, a többi üres tér (a folyadékoknál molekulák a tér 70% foglalják el). A gázok tömöríthetőek. Minden rászecske úgy viselkedik mintha a többi részecske nem is lenne a közelben. A különböző gázok hasonlóan videlkednek habár más-más molekulákból állnak.
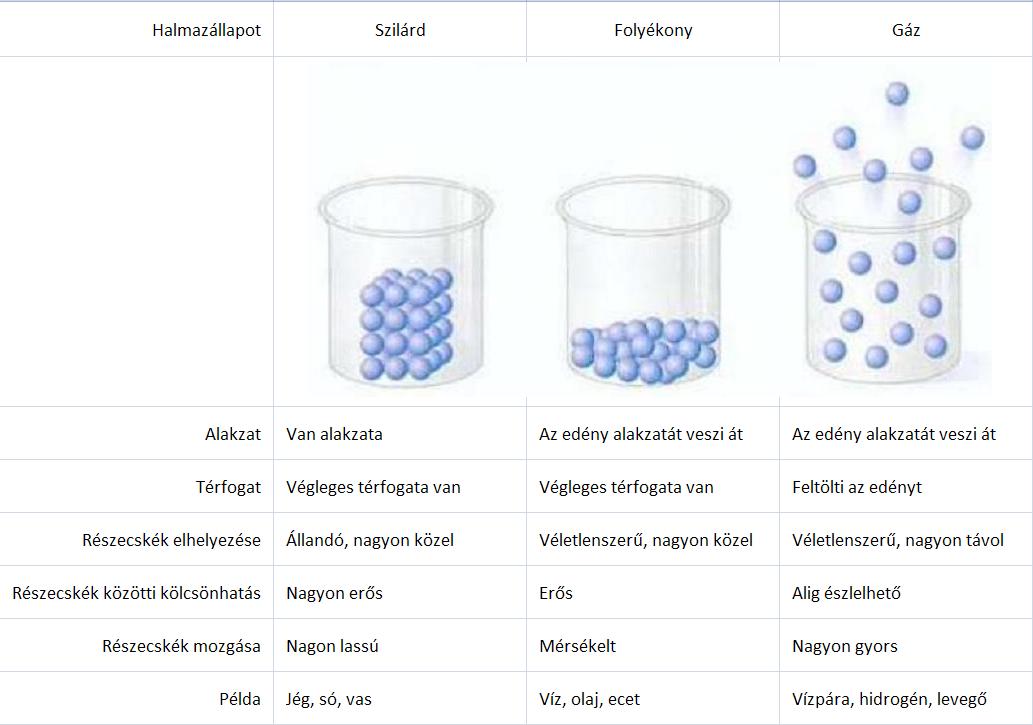
A szilárd, folyékony és gázanyagok tulajdonságai:
Gázelemek és vegyületek
Gáz állapotban 12 elem van. Monoatom (nemes gázok) és kétatomos molekulák.
Minden amit felmelegítünk a forráspontjáig, gázhalmazállapotba változik. A gázok közé azokat az elemeket tartják, melyek rendszerinti állapotban gázneműek.
Az elemeken kívül egyes vegyületek rendszerinti állapotban gázneműek:
HCN - hidrogén-cianid
H2S - kén-hidrogén
CO - szén-monoxid
CO2 - szén-dioxid
CH4 - metán
C2H4 - etilén
C3H8 - propán
N2O - dinitrogén-oxid
NO2 - nitrogén-dioxid
NH3 - ammónia
SO2 - kén-dioxid
A gázvegyületek többnyire kis molekuláris tömeggel rendelkeznek.
A hőmérséklet T[K], térfogat V[m3] és a nyomás p[Pa] a három ismert és már régóta meghatározható (mérhető) tulajdonságai a gázoknak.
A gázok tanulmányozásánál két elméleti modelt alkalmaznak a mai fizikában:
- kinetikus gázelmélet model a molekuláris struktúrából kiinduló. A részecskék nagy számának a kinetikus (mozgásenergia) és a sebesség középértékeinek figyelembevételével kiszámíthatóak az értékek melyek a gázok jellemzői a nyomás, hőmérséklet, és belső energia.
- termodinamikai (makroszkóp) model nem veszi figyelembe a gázok belső struktúráját és két alapelv határozza meg. Termodinamika biztosítja a kapcsolatot a nyomás, térfogat, hőmérséklet, hőmennyiség és entrópia között makroszkópiai szinten.
A részecskék mozgása
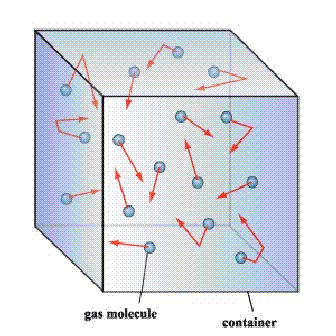
A gázok részecskéjei (molekulák és atomok) állandó jellegű káotikus (rendszertelen) mozgásban vannak. Mozgásuk rendszertelensége a részecskék sebességeinek különböző sebesség iránya, irányítása és intenzitása mutatja. A részecskék sebességei a kis értékektől (majdnem nyugalmi állapottól) a nehányszáz méter per másodpercig terjed. Minden irány ás irányítás egyformán találató (külső kihatás jelenléte nélkül). Az ütközések száma nagyon nagy, emiatt a részecskék útiránya sokszor megtört egyenesre hasonlít (cikk-cakk vonalra emlékeztet).
A gáz részecskéinek sebességeloszlása
A gázok részecskéjei nagyon különböző sebességekkel mozognak és különböző mozgási energiával rendelkeznek bizonyos hőmérsékleten meghatározható az átlagsebesség és az átlagmozgási energia. A részecskék ütközése nagyon gyakori esemény. Egy bizonyos gázban egy adott pillanatban a részecskék nagyon eltérő sebeségekkel mozognak.
A diagramokon az x tengelyen a részecskék sebességei vannak kimutatva nullától a maximális sebességig, amíg az y tengelyen az n részecskék száma. A diagram mutatja hogy az adott sebességgel hány részecske mozog. A vn sebességgel mozog a legtöbb részecske, amíg a nulla illetve a maximális sebességgel a legkevesebb részecske mozog. A sebesség középértéke v (felső vonallal) valamivel nagyobb mint az előző sebesség és valamivel kevesebb részecske mozog ezzel a sebességel.
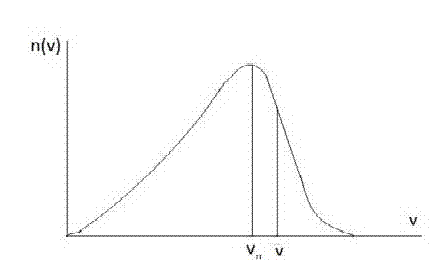
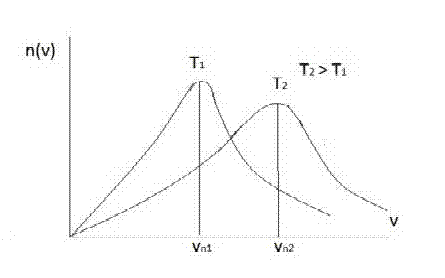
A grafikonról leolvasható hogy a hőmérséklet növelésével a nagyobb sebességekkel rendelkező részecskék száma nől, illetve a részecskék mozgása rendszertelenebb (káotikusabb).
Az ideális gáz modellje
Ideális gáz nem létezik a természetben. Az ideális gáz nagyon apró részecskékből áll és emiatt a részecskék közötti vonzóerők elhanyagolhatók.
Az ideális gázok részecskéit nagyon apró rugalmas golyókként képzelhetjük el melyek gyakran ütköznek egymással és az edény falaival amelyben vannak. Az ütközések rugalmasak (a részecske mozgási energiája és sebessége nem változik az ütközés után).
A gáz nyomása
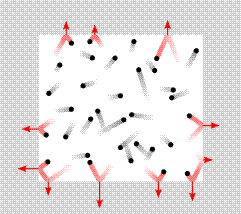
A részecskék rendszertelen mozgásnak eredménye a nagy számú ütközés az edény falaival melyben a gáz van. Az edény falaihoz való ütközés alkalmával a részecskék megváltoztatják a mozgás irányát és irányítását.
Az ütküzések alkalmával a részecskék bizonyos nyomást végeznek az edény falaira melyben a gáz található. A nyomás amely ilyen alkalommal észlelhető néhány tényezőtől függ: mennyiség (részecskék koncentrációja az adott gázban), a részecskék sebességének középértéke és a részecskék tömege. Az alábbiak alapján, kihagyva a képlet levezetését meghatározató a kinetikus gázelmélet alaképlete:
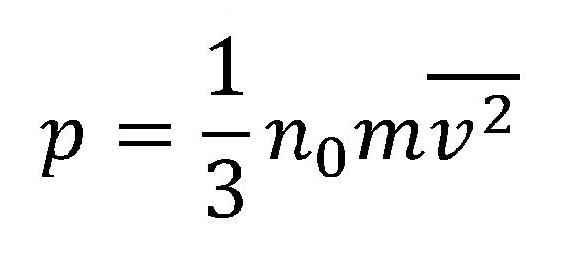
A képletben:
- p - nyomás[Pa]
- n0 - részecskék mennyisége (a részecskék száma egységes térfogatban) [1/m3]
- m - részecske tömege [kg]
- v(felülhúzva) - részecskék sebességének középértéke [m/s]
Az ideális gáz átlagos mozgási energiája
Az ideális gáz átlagos mozgási energiája arányos az abszolút hőmérséklettel (másszóval az ideális gáz átlagos mozgási energiája a gáz hőmérsékletétől függ):
A képlet levezetése a gázok részecskéinek átlagos mozgásenergiájából indul, alkalmazva a káotikusan mozgó részecskék sebességeinek felosztását.
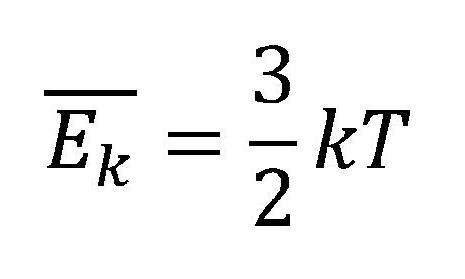
A képletben:
- Ek - az ideális gáz átlagos mozgási energiája [J]
- k - Boltzmann állandó 1,38.10-23 [J/K]
- T - hőmérséklet [K]
Az ideális gáz állapota
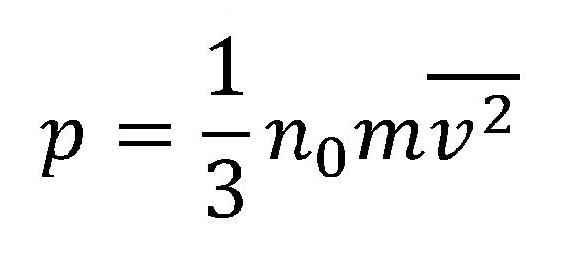
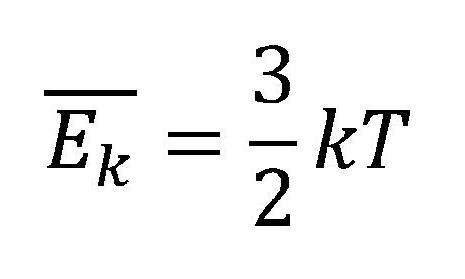
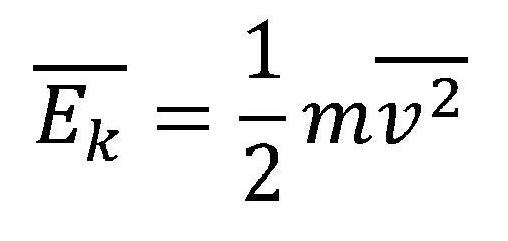
Amennyiben az előző két képlettel kombináljuk ezt a harmadik képletet a
mozgási (kinetikus) energia képlettel, az alábbiakban lévők alkalmazásával:
* mv2 közös az első és harmadik képletben és
* Ek közös az második és harmadik képletben.
Ennek alapján meghatározható az ideális gáz alapegyenlete:
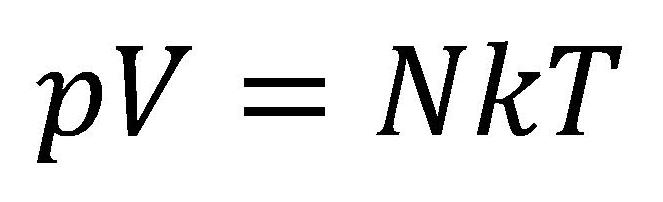
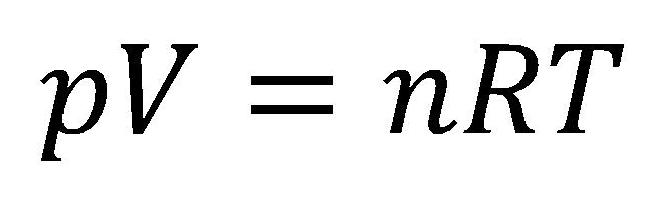
A képletekben:
- p - nyomás [Pa]
- V - térfogat [m3]
- N - részecskék koncentrációja (a gáz részecskéinek száma egy egységes térfogatban) [1/m3]
- k - Boltzmann állandó 1,38.10-23 [J/K]
- T - hőmérséklet [K]
- n - gázmennyiség [mol]
- R - egyetemes gázállandó 8,314472 [J/(molK)]
Állandó részecskeszám (N-const) esetén a gáz nyomásának és térfogatának szorzata egyenesen arányos a gáz abszolút hőmérsékletével.
A hőmérséklet és az abszolút zérus fok (nullapont)
Az anyag mozgáselmélet alapján a hőmérséklet szűk összefüggésben áll a belső energiával amely a gázoknál csak a részecskék mozgásenergiájára utal. A potenciális energia amely a gázrészecskék egymásközötti hatást képviseli, elhanyagolható mivel a részecskék távolsága sokkal nagyobb mint a folyadékok vagy szilárd anyagok esetéban.
A hőmérséklet egyenesen arányos a káotikusan történő részecskék mozgásának mozgási energia középértékének.
Ilyen módon van deffiniálva az abszolút hőmérséklet. A jelölése T és az egyik a hét fizikai alapérték közül.
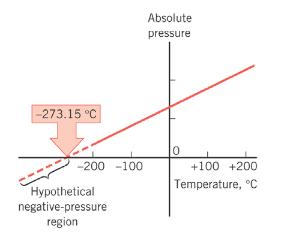
A hőmérséklet akkor nulla amikor a részecskék mozgási energia középértéke nulla. Ez a hőmérséklet legkisebb értéke. A hőmérséklet melyen a részecskék mozgása leáll (a mozgásenergia és a sebesség nulla), el van nevezve mint abszolút zérus fok illetve nullapont.
A 19. évszázad közepén elméleti úton meg lett határozva a legalacsonyabb hőmérséklet amely értéke -273.150C (abszolút zérus fok). A hőmérséklet amelyet az abszolút nullától kezdve mérnek az abszolút hőmérséklet illetve Kelvin hőmérséklet. A nemzetözi mértékegységekben a hőmérséklet Kelvin fokokban van kifejezve (K). A kelvin fok megegyezik a celzius fokkal, a külonbség 273.15 fok a két skála nulla pontja között.
A Boyle - Mariotte törvény
Az ideális gáz állapota egyértelmű meghatározásához szükséges egyidejűleg
ismerni ezeket az értékeket: a gáz mennyiségét, nyomását, térfogatát és
hőmérsékletét. A gázokban történő folyamatokat megközelíthetőleg úgy
tekinthetjük mint folyamatok melyekben csak két érték változik amíg a
többi érték állandóak:
* izoterm (állandó hőmérséklet),
* izochor (állandó térfogat),
* izobár (állandó nyomás).
Robert Boyle, ír származású angol fizikus és vegyész, Newton kortársa, egyike a Brit tudományos akadémia alapítójai közül. Oxfordban dolgozott és kisérleti úton meghatározta a gázok nyomásának összefüggését a térfogattal, állandó hőmérsékletnél. Függetlenül tőle ugyanazt az összefüggést fedezte fel francia fizikus Mariotte is. Emiatt ez a törvény mindkét tudós nevét viseli.
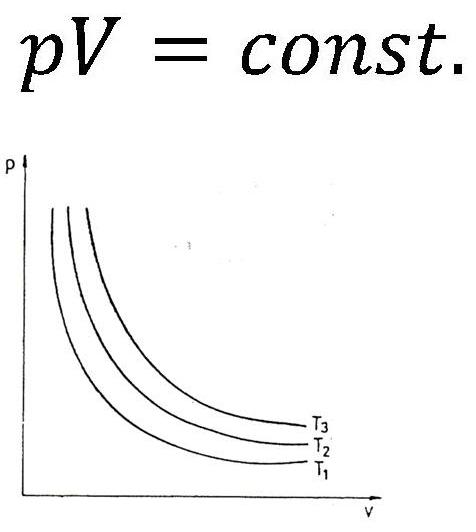
Az izoterm folyamatoknál (állandó hőmérsékletnél történő folyamatoknál) érvényes:
A nyomás és a térfogat szorzata állandó hőmérsékletnél nem változik.
Charles törvénye
A nyomás és hőmérséklet összefüggését kísérleti úton elsőnek Francia fizikus Charles tanulmányozta.
A hőmérséklet növelésével a nyomás is növekszik, és ez az összefüggés
lineáris (egyenesvonalú).
Az egyenest amely a nyomás és hőmérséklet összefüggését mutatja állandó
térfogatnál izochornak nevezik.
Gay-Lussac törvény
Gay-Lussac francia fizikus és vegyész a Párizsi tudományos akadémia tagja volt. Kísérletezett a gázok térfogata és hőmérséklete összefüggésével állandó nyomás mellett. Megatározta e értékek kapcsolatát amely törvény manapság az ő nevét viseli: Gay-Lussac törvény. Bebizonyította hogy a terjedési együttható egyforma minden gázra és meghatározta értékét: γ=1/273.15 0C.
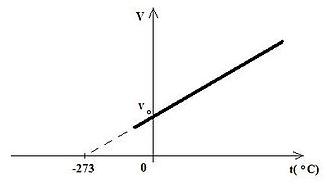
Az állandó mennyiségű gáz térfogata állandó nyomáson lineáris függvénye a hőmérsékletnek.
Az egyenes amely a gáz térfogat változását mutatja a hőmérséklet függvényében állandó nyomáson izobárnak nevezik.
A tananyaghoz fűződő videófelvétel