2. osztály - Fizika
4. Molekuláris erők és halmazállapotok
Molekuláris erők
Az anyagok tanulmányozása során bizonyítva lett hogy az anyagok részecskéi (atomok vagy molekulák) között molekuláris erők hatása érezhető. Ezek az erők vonzó vagy eltaszítók lehetnek. Ezen erők hatása nélkül a testek szétesnének vagy összefolynának egy tömegbe. A példák az erők jelenlétére: az üveg elválasztása vizes sima felülettől, két vízcsepp összefolyása egy cseppbe...
A molekuláris erők rövid távokon hatnak (a gázok
tanulmányozásánál el lettek hanyagolva). A távolság szerint
feloszthatóak mint:
- vonzó (a részecskék közötti távolság nagyobb mint a részecske átmérője, illetve a távolságok nagyobbak mint kb. 10 -10m) vagy
- eltaszító (a részecskék közötti távolság kisebb mint a részecske átmérője)
A jelenség magyarázata az elektromágneses tér tulajdonságaiból ered: az első részecske elektronjai vonzák a második részecske magját amíg a második részecske magja vonza az első részecske elektronjait, amennyiben a két részecske kis távolságon van, de valamivel nagyobb távolságon mint a részecske átmérője. Amennyiben a távolság kisebb mint a részecske átmérője a mindkét részecske magja eltaszító erővel fog hatni egymásra, ugyanúgy mindkét részecske elektronjai is eltaszító erővel fognak hatni egymásra.
A szilárd testek hőtágulása
Ismert a jelenség hogy a hő hatására a testek tágulnak. A távvezetékek képei ismertek és szemmellátható példái ennek a jelenségnek. A hő átvétele alkalmával a testek részecskéi belső energiája növekszik és a "mozgásuk" által egymást ellökik maguktól hogy nagyobb teret csináljonak mozgásuknak, illetve a test tágul. A test tágulása minden irányban észlelhető.


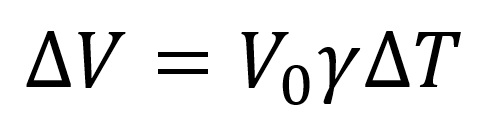
A képletben:
- ΔV - a test térfogat növekvése
- V0 - a test térfogat eredeti mérete
- γ - a térfogattágulás együtthatója (a fémeknél kis értéke van: (2-5)*10-5K-1)
- ΔT - a hőmérséklet változása
A kristályok
A testeket melyeknek állandó az alakjuk és térfogatuk szilárd testeknek nevezik. A szilárd testek kristály vagy amorf testek lehetnek.
A kristály testekben a részecskék (atomok, ionok vagy molekulák) a térben szabályosan vannak elhelyezve, ezzel az elhelyezésel kristály struktúrát alakítják. A kristály részecskéi között erős vonzó erök léteznek. Mivel minden részecske körbe van véve minden oldalról másik részecskékkel a vonzó erők egyensülyban vannak és a részecskék meghatározott helyeken vannak elhelyezve. A kristály modellezése alkalmával a helyek melyeken a részecskék találhatóak csomókkal vannak képviselve, amíg az erők a csomók közötti vonalakkal vannak jelölve. Ilyen módon lehet a szabályos háromdimenziós rácsot megkapni.
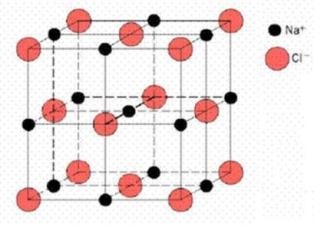

A kristályrács alap építőeleme a elemi cella mely hasáb alakú és a sarkaiban a részecskék vannak. Ilyen alapelem ismétlése a három térbeli tengely mentén építi a kristályrácsot.
Mniden kristály struktúra alaptulajdonsága az ismétlődés a kristályrácsban.
A képen a kristály és amorf test felépítése látható:
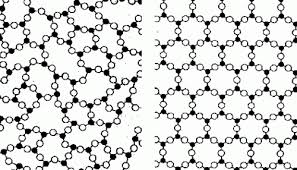
A belső felépítésük alapján az amorf testek a folyadékokra emlékeztetnek, például gyanták, üveg, műanyag tárgyak. A mechanikai jellemzői alapján meg a szilárd testekhez közeliek. A részecskéi az az egyensúly pont környékén oszcillálnak, de nem szabályos az elhelyezésük. Nincs állandó olvadás hőmérsékletük.
A rugalmasság - Hooke törvénye
Külső erők vagy hőmérséklet változás hatására a szilárd testek mérete, alakja, és térfogata változik. Az ilyen változásokat deformációknak nevezik. Az erők hatása megszűntével ha a test visszanyeri az eredeti tulajdonságait a testet rugalmasnak nevezik, ellenkezőleg a test tartós deformációt szenved. A deformáció a test szerkezetétől és az erőtől függ. A példák: rugalmas tárgyak az acél és a gumi, amíg a réz és gyanta nem rugalmas tárgyak.
A deformaciók négy alaptipusa: húzás-nyomás, hajlítás, nyírás és csavarás.
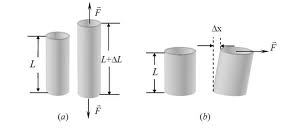
A gyakorlatban leggyakrabban a húzás (megnyúlás) van jelen. Amenyyiben csak az egyik tengely mentén érezhető a deformáció, a többi tengely mentén meg elenyésző. Δl - a test hosszának változása a test méretétől, a test építőanyagától és az erő intenzitásától függ.
A Hooke törvénye:
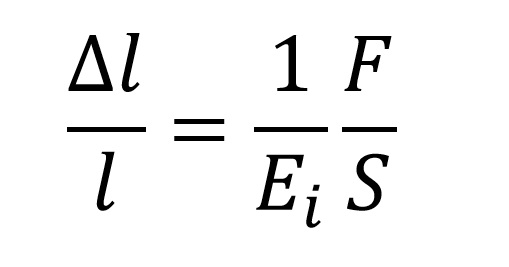
A képletben:
- Δl/l - relatív megnyúlás
- Ei - Younge modulus
- F - az erő mely a testre hat
- S - a test felülete
A Younge modulus mutatja a test ellenállását a nyújtással szemben. Az értéke a fémeknél kb. 1011 N/m2.
Az anyagok melyeknél nem létezik rugalmasság: viasz, agyag, gyurma, stb.
Folyékony halmazállapot
A folyadékok egyes tulajdonságia alapján a gázokra emlékeztetnek, egyes tulajdonságai alapján meg a szilárd tárgyakra. A folyadékok ugyanúgy mint a gázok nyomást gyakorolnak a testekre melyek bennük vannak (fölhajtóerő), amíg a nyomás bennük azonosan terjed minden irányban. A gázok feltöltik a teljes teret melybe kerülnek, nincs állandó alakjuk és térfogatuk, amíg a folyadékoknak meg van a térfogatuk mint a szilárd tárgyaknak, de nincs meg az alakjuk (felveszik az edény alakját).
A viszkozitás
A viszkozitás a belső súrlódás jelenléte a folyadékokban. A
viszkozitás ellenkezik a folyadék folyásának meg a
mozgásnak a folyadékban.
Hol könnyebb futni: a parton, a sekély vízben vagy a mély vízben?



A folyadék laminárisan (rétegekben) mozog. Különböző rétegek különböző
sebességekkel mozognak. Példa a folyó: a sodráasl szemben legkönnyebb a part
mentén evezni, amíg a folyó közepén lehet leggyorsabban haladni lefelé (a
folyásal egyirányban). A víz rétege amely a folyó medréhez a legközelebbi,
nem mozog, a befelé felé haladva a rétegek gyorsabban mozognak.
A folyó mely részén halad a csónak könnyebben a sekély vagy a mély vízben
(mindkét haladási irányt a folyó sodrásához viszonyítva figyelembe venni)?
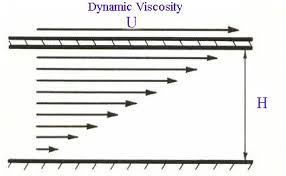
A folyadék mozgása a csőben nem egyforma. A cső közepén a folyadék folyik leggyorsabban, a cső közepétől távolodva a folyás sebessége csökken.
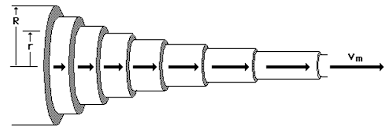
Newton törvénye
A viszkozitás - a folyadék belső ellenállása a viszkozitás erővel lehet magyarázni, amennyiben a folyás réteges (lamináris). E modell alapján a rétegek egymáson csúsznak és a rétegekhez tartozó részecskék állandóan a saját rétegükben tartózkodnak. A viszkozitás surlódás erő a folyadék fajtájától függ.
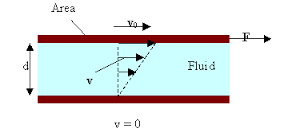
A példa mely alapján a Newton törvényét legegyszerübb magyarázni: a két lemez d távolságon egymástól és közöttük folyadék van, melynek a viszkozitás együtthatója η. Az alsó lemez nem mozog, a felső lemez v sebességgel mozog és a felülete meg S.
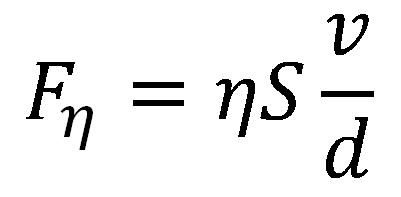
A víznél ez az erő gyenge és a víz gyorsan kifolyik az edényből, amíg ugyanaz a mennyiségű olaj lassaban fog kifolyni.
Stokes törvénye
A folyadék viszkozitás erő a folyadékban lévő tárgyak mozgását gátolja (tengeralattjáró, búvar). A folyadék gétolja a test mozgását a létező viszkozitása végett. A folyadék vékony rétege a testhez van ragadva és a testel együtt mozog. E mozgás által a folyadék többi rétege is mozog.
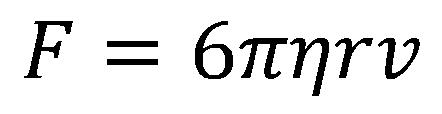
Ez a képlet a Stokes viszkozitás törvénye amely a gömb alakú tárgyakra vonatkozik.
A felületi feszültség
A felületi feszültség a folyadék részecskéi közötti vonzóerő eredménye. A folyadék belselyében minden részecskét egyformán vonzanak a környékében lévő részecskék, az eredő erő egyenlő nullával. A folyadék felszínén lévő részecskéket lefelé vonzák a folyadék belsejében, mélyebben lévő részecskék. A folyadék felszín feletti részecskék melyek más anyaghoz tartoznak (levegő, vákum, vagy más), nem vonzák olyan erősen a folyadék felszínén található részecskéket. A folyadék felszínén lévő részecskéket ilyen módon egyensúlyba hozná a folyadék felszínén jelentkező ellenállás a nyomásra, illetve egy erő mely csökkenti a folyadék felületét és egy vékony rugalmas hártyát ábrázol a folyadék felszínén. A folyadék íly módon fogja a mozgását befelyezni amikor eléri a lehető legkisebb felületet.
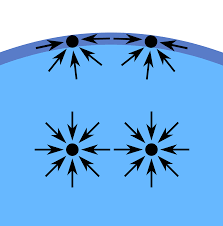




A jelenséget így is lehat magyarázni: a részecskék melyeknek a szomszédságukban van másik részecse (a folyadék belsejében található részecskék), alacsonyabb energiaszínten vannak mit a részecskék melyek szomszédságukban nem található más részecske. A folyadék határain található részecskéknek kevesebb szomszédos részecskéjük van és emiatt ezek a részecskék magosabb energiaszínten vannak. Hogy a folyadék csökkentse a belső energiáját, csükkenti a folyadék határain található részecskéket, illetve csökkenti a határfelületet.
Fázisátalakulások
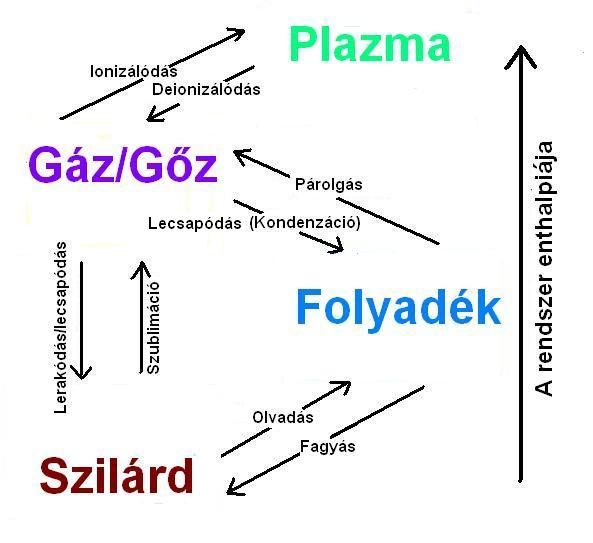
Minden anyagnál a hőmérséklet változtatása okozza a halmazállapot változását. A szilárd anyagok melegítése az anyag olvadásához vezet, további melegítés meg a párolgáshoz vezet. A lehülés fordított folyamatokat okoz: a gőzből folyadék lessz, majd szilárd anyag. Léteznek helyzetek amikor a szilárd anyag közvetlenül gázzá változik, ezt a folyamatot szublimációnak nevezik.
Az anyag halmazállapotát fázisoknak is nevezik. Minden anyagnak három halmazállapota van: szilárd, folyékony és gáz. A negyedik halmazállapot a kevésbé ismert plazma.
Az anyag halmazállapot változását fázisátalakulásnak is nevezik.
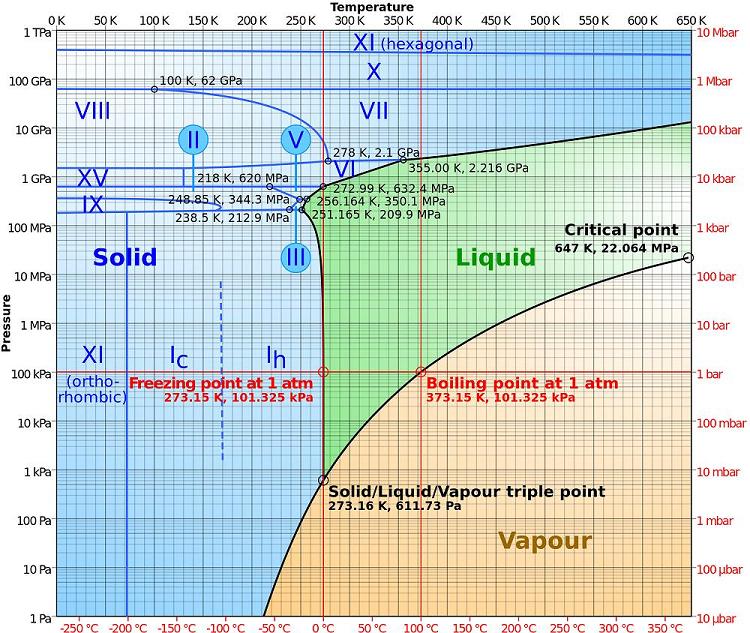
A halmazállapot változtatás
Az anyag átmenetele az egyik halmazállapotból a másikba egy megadott nyomásnál mindig ugyanazon a meghatározott hőmérsékleten történik. A légöri nyomásnál a jég olvadni kezd a 00C és a további melegítésnél a hőmérséklet állandó marad amíg a teljes jégmennyiség nem olvad el. Ennél a hőmérségletnél a jég és a víz egy időben léteznek egymásal éritnkezve is.
A külső hatások elmaradásával (például a hőmérséklet növekedése és állandó nyomás) az állapot melyben a két fázis (jég és víz) egyidőben jelen vannak (00C), végtelenül sokáig tarthat. Amennyiben a hőmérséglet valamivel nagyobb vagy kisebb, csak egy fázis lehet egyidelyűleg jelen. Például a légköri nyomásnál és 00C alatt csk jég létezhet, és 00C felett csak víz.
Az szilárdtest állapota csak a kristályos állapot. Az amorf szilárd test hevítve folyadékká alakul fokozatok és átmenetelek nélkül. Ezért az amorf szilárd test nem képez az anyag különálló fázisát, hanem egy specifikus átmeneti fázist.
A szilárd testre azt mondják, hogy amorf, ha a részecskéi nem szabályos sorrendben vannak mint a kristályoknál. Az amorf testekre a példák üveg, gélek, vékonyrétegek és nanoszerkezetű anyagok. Az amorf anyagoknak van egy bizonyos elrendezése a részecskék között, csak nagyon rövid távolságokon, de nincs elrendezés az egész az egész anyagban. A kristályos anyagoknál egy minta ismétlődik az egész rácsban a részecskék közötti vonzó erő azonos, emiatt melegítésnél a részecskék közötti kapcsolatok hirtelen megszakadnak egy bizonyos hőmérsékleten és a kristályoknál emiatt pontosan meg van határozva az olvadás hőmérséklete. Másrészt az amorf anyagok részecskéi között sem azonosak a távolságok sem a vonzó erők nem egyformák, a test melegítésénél nincs egy hirtelen átmenet a folyékony állapotba, hanem egy bizonyos hőmérséklet intervallumban a test elpuhul és utánna vállik folyékonnyá. A részecskék az amorf testeknél káotikusan vannak elhelyezve szilárd állapotban is, folyékony állapotban a részecskék sokkal mozgékonyabbak. Emiatt az üvegeket néha megfázott folyadékoknak nevezik.
Olvadás és fagyás (dermedés)


A szilárd testek átmenetét folyékony állapotba olvadásnak nevezik. A fordított átmenet meg dermedés. A hőmérsékletek melyeknél ezek a fázisátalakulások történnek olvadási illetve dermedési hpmérsékleteknek (pontoknak) nevezik.
A test melegítése alkalmával a részecskék hőmozgása nővekszik. A részecskék mozgásukkal növelik a kristályrácsban az egymásközötti távolságukat és a kristályrács egy pontban szétesik. A részecskék így szabadulnak az erős vonzóerőktől melyek a kristályrácsban szorosan tartják őket. Ilyen módon történik a szilárd test olvadása. Mindegyik anyagnak ez egy bizonyos hőfok és nyomás értékénél történik.
Párolgás és lecsapódás


A Párolgás az anyag átmenetele a folyékonyból a gázhalmazállapotba. A hőmérséklet növekedésével a párolgás intenzitása is növelkszik. Ugyanazon a hőmérsékleten különböző folyadékok eltérő intenzitásal párolognak. Az éter vagy a benzin gyorsabban párolognak mint a víz vagy az étolaj. Az éter vagy a benzin gyorsabban párolognak mint a víz, mivel a molekulái között gyengébbek a vonzóerők az adott hőmérsékleten mint a víz molekulái között.
A legintenzívebb átmenetel a folyékony halmazállapotból a gáz halmazállapotba a forrás ideje alatt történik. Olyankor a folyadék részecskéi a folyadék teljes térfogatából a folyadékot elhaggyák - a folyadék párolog. Ez egy adott hőmérsékleten történik - a forrás hőmérsékletén és ez a folyadék fázisátalakulása gázhalmazálapotba.
A hőmennyiség melyet egy kilógramm folyadéknak át kell adni hogy elpárologjon (állandó hőmérsékletnél), a specifikus (latens) párolgási hőmennyiség.
A forrás hőmérséklete a nyomástól függ. A víz 500C fokon is forrhat csökkentett nyomásnál, ugyanúgy 1200C fokon is megnövelt nyomásnál. Emiatt a párolgást vonal írja le, nem csak egy meghatározott pont.
A gőz részecskéi (mint minden gáznál) káotikus mozgást végeznek. A káotikus mozgás által a részecskék egy része az ütközések miatt elveszítik energiájukat és visszaesnek a folyadékba melyből elpárologtak. Ezek szerint a párolgással egyidőben a fordított folyamat - kondenzáció (lecsapódás) is történik.


Kondenzáció a folyamat melynél a gáz folyékony halmazállapotba kerül. E folyamatnál az anyag hül. Ez a fázisátalakulás ellentétes a párolgással.
Érdekességek
Halmazállapotok és fázsiátalakulások