2. razred - Fizika
1. Molekulsko kinetička teorija gasova
Osobine gasova
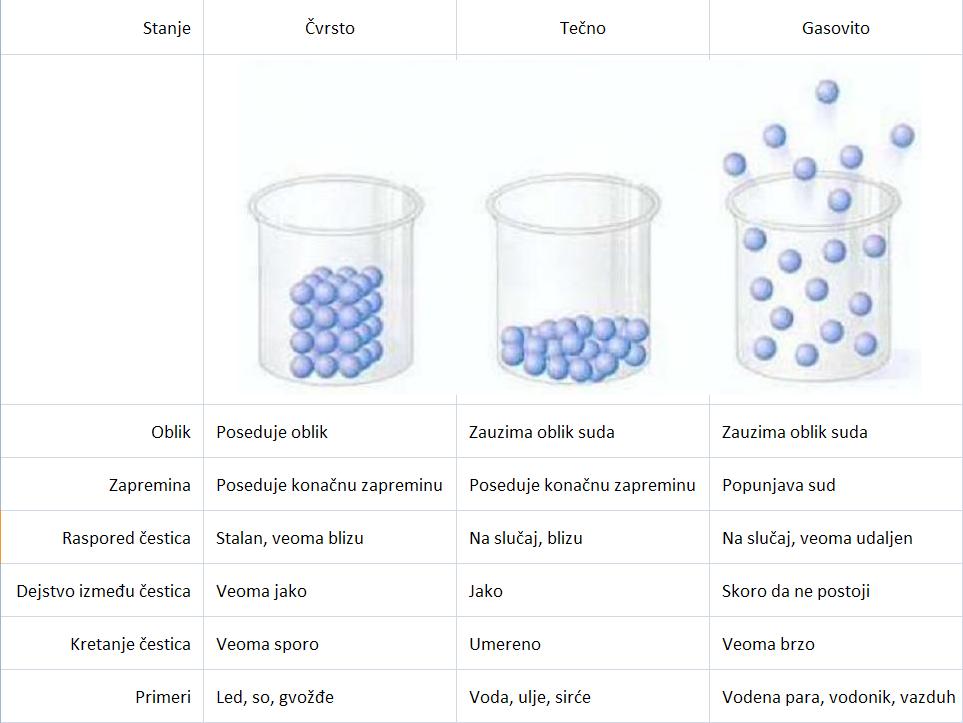
Nema zapreminu, gas se prilagođava obliku i zapremini suda u kojem se nalazi. Gasovi međusobno prave homogene smese, bez obzira na vrstu i odnos gasova u smesi. Čestice gasa (atomi i molekuli) zauzimaju samo 0,1% ukupne zapremine, ostalo je prazan prostor (kod tečnosti molekuli zauzimaju 70% zapremine). Gasovi se mogu sabijati. Svaka čestica se ponaša kao da ostale čestice nisu prisutne. Različiti gasovi se ponašaju slično iako se sastoje od različitih čestica.
Poređenje čvrstih, tečnih i gasovitih materijala:
Gasoviti elementi i jedinjenja
U gasovitom stanju postoji 12 elemenata. Monoatomski (plemeniti gasovi) i dvoatomski molekuli.
Sve kada se zagreje do tačke ključanja prelazi u gasovito stanje. Pod gasovima se podrazumevaju samo one supstance koje su gasovite pri normalnim uslovma.
Osim elemenata i neka jedinjenja su gasovita pri normalnim uslovima:
HCN - cijanovodonična kiselina
H2S - vodonik sulfid
CO - ugljen monoksid
CO2 - ugljen dioksid
CH4 - metan
C2H4 - etilen
C3H8 - propan
N2O - azot suboksid
NO2 - azot dioksid
NH3 - amonijak
SO2 - sumpor dioksid
Gasovita jedinjenja su jedinjenja uglavnom male molekulske mase.
Temperatura T[K], zapremina V[m3] i pritisak p[Pa] su tri osobine gasova koje su poznate i već duže vreme su poznati načini njihovog merenja.
Pri proučavanju gasova koriste se dva teorijska metoda:
- molekulsko-kinetički metod polazi od molekulske strukture. Uzimanjem srednjih vrednosti brzina i kinetičkih energije ogromnog broja čestica, mogu se izračunati vrednosti veličina koje opisuju stanja gasova, kao što su pritisak, temperatura, unutrašnja energija.
- termodinamički (makroskopski) metod zanemaruje unutrašnju strukturu gasova, i zasniva se na dva principa. Termodinamika uspostavlja vezu između veličina koje opisuju makroskopsko stanje gasa, kao što su: pritisak, zapremina, temperatura, količina toplote, entropija.
Molekulsko kretanje
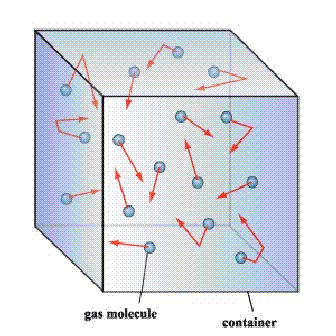
Čestice gasova (molekuli i atomi) se neprekidno i haotično kreću. Haotičnost kretanja (neuređenost) se ogleda u kretanju čestica čije se brzine razlikuju po intenzitetu, pravcu i smeru. Brzine čestica su u rasponu od veoma malih vrednosti (skoro da miruju) pa sve do brzina od nekoliko stotina metara u sekundi. Svi pravci i smerovi kretanja čestica su podjednako zastupljeni (bez spoljašnjeg uticaja) i broj međusobnih sudara je veoma velik, te su njihove putanje oblika izlomljenih linija.
Raspodela molekula po brzinama
Iako čestice gasa na nekoj temperaturi imaju neku prosečnu kinetičku energiju i neku prosečnu brzinu, čestice se kreću različitim brzinama. Sudari između molekula gasa su veoma česti. U nekom gasu u datom trenutku imamo molekule koji se kreću veoma razičitim brzinama.
Na dijagramima na x osi je prikazana brzina čestica od nule do maksimalne brzine a na y osi je n broj čestica. Dijagram prikazuje koliki broj čestica ima date brzine. Brzinu vn ima najviše čestica, dok brzinu nula i maksimalnu brzinu ima najmanji broj čestica. Srednja vrednost brzine v (sa crticom iznad) je nešto veća od prethodne brzine i srednju vrednost ima nešto manji broj čestica.
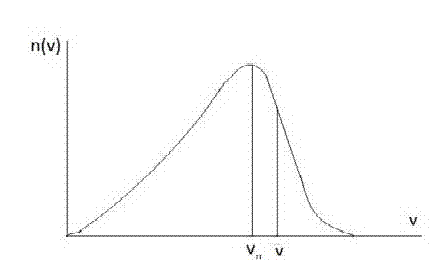
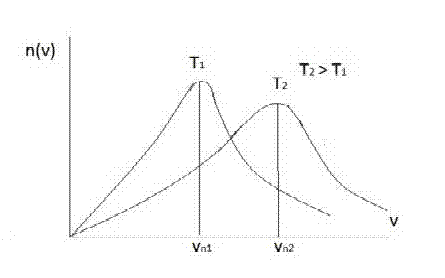
Sa grafikona se vidi da povećanje temperature uzrokuje povećanje broja čestica sa većim brzinama, tojest kretanje postaje haotičnije.
Model idealnog gasa
Idealan gas je gas koji u prirodi ne postoji. Idealan gas je sastavljen od veoma sitnih čestica, i zbog toga su međumolekularne sile privlačenja i odbijanja zanemarljive, odnosno zanemaruje se interakcija između čestica gasa.
Čestice idealnog gasa se mogu zamisliti kao elastične kuglice zanemarive zapremine (veoma sitne) i čiji su međusobni česti sudari kao i sudari sa zidovima suda u kome se nalazi apsolutno elastični (kinetička energija čestica pre i posle sudara je nepromenjena a samim time i brzina čestica).
Pritisak gasa
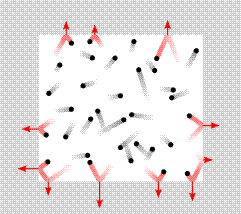
Usled haotičnog kretanja čestica gasa dolazi do sudara čestica sa zidovima posude u kojoj se nalazi dati gas. Čestice gasa pri sudaru sa zidom posude menjaju pravac i smer kretanja.
Prilikom sudara čestice vrše određeni pritisak na sud sa kojim se sudaraju. Pritisak kojim čestice na ovaj način vrše na zidove suda zavisi od nekoliko veličina: količine (koncentracije čestica u datom gasu), srednje vrednosti brzina čestica kao i mase čestica. Na osnovu navedenog, ne upuštajući se u izvođenje dolazi se do osnovne jednačine molekulsko-kinetičke teorije gasova:
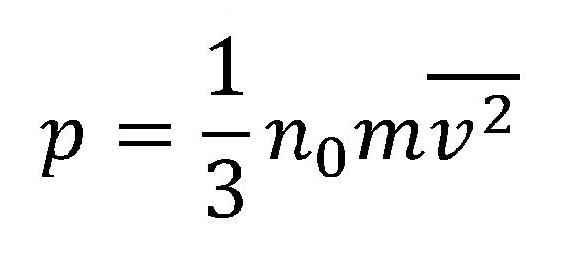
Pri čemu je:
- p - pritisak[Pa]
- n0 - koncentracija čestica (broj čestica u jedinici zapremine) [1/m3]
- m - masa čestice [kg]
- v(nadvučeno) - srednja vrednost brzina kretanja čestica [m/s]
Srednja kinetička energija idealnog gasa
Srednja kinetička energija čestica idealnog gasa srazmerna je apsolutnoj temperaturi (drugim rečima srednja kinetička energija čestica idealnog gasa direktno zavisi od temperature gasa):
Izvođenje ove formule kreće od srednje vrednosti kinetičke energije translatornog kretanja čestica gasa uz upotrebu raspodele brzina haotičnog kretanja čestica gasa.
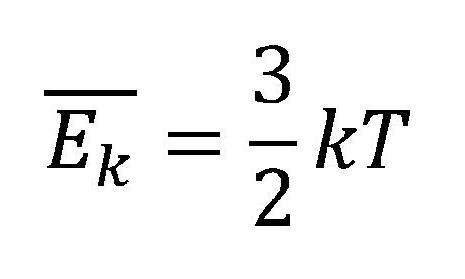
Pri čemu je:
- Ek - srednja kinetička energija idealnog gasa [J]
- k - Bolcmanova konstanta 1,38.10-23 [J/K]
- T - temperatura [K]
Jednačina stanja idealnog gasa
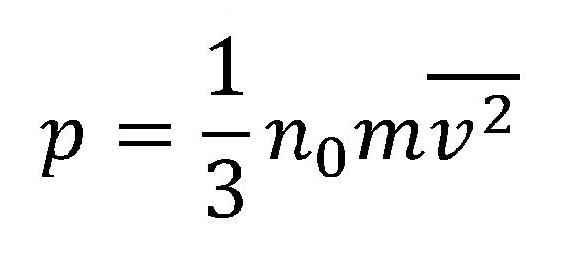
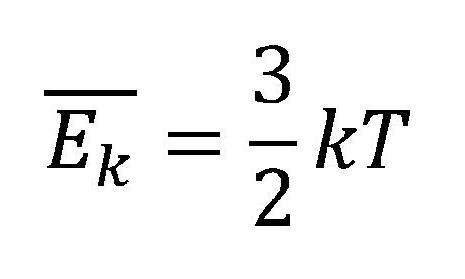
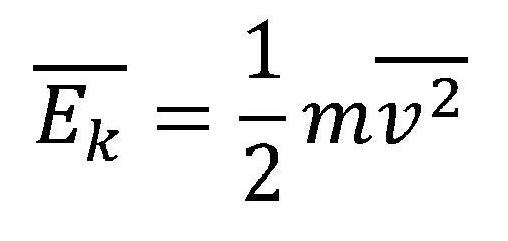
Ukoliko se pogledaju prethodne dve formule i kombinuje se sa ovom
trećom formulom za kinetičku energiju, na osnovu sledećeg:
* mv2 je zajedničko u prvoj i trećoj formuli a
* Ek je zajedničko u drugoj i trećoj formuli.
Na osnovu ovoga se dolazi do opšte jednačine stanja idealnih gasova koja glasi:
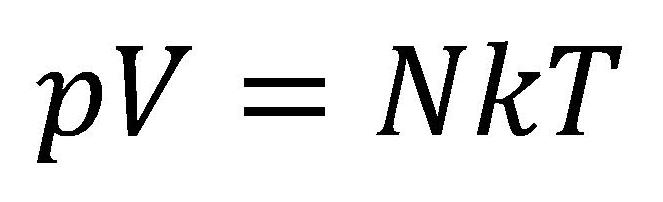
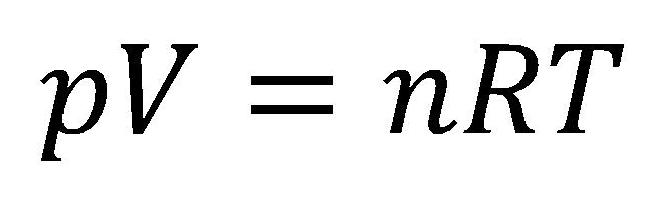
U ovim jednačinama su:
- p - pritisak [Pa]
- V - zapremina [m3]
- N - koncentracija čestica (broj čestica u jedinici zapremine) [1/m3]
- k - Bolcmanova konstanta 1,38.10-23 [J/K]
- T - temperatura [K]
- n - količina gasa [mol]
- R - univerzalna gasna konstanta 8,314472 [J/(molK)]
Proizvod pritiska i zapremine određene količine gasa (N-const) srazmeran je apsolutnoj temperaturi tog gasa.
Temperatura i apsolutna nula
Sa stanovišta kinetičke teorije supstance, temperatura je tesno povezana sa unutrašnjom energijom koja se kod gasova praktično svodi na kinetičku energiju čestica (atoma ili molekula). Potencijalna energija uzajamnog delovanja čestica gasa može se zanemariti jer su rastojanja između čestica znatno veća u odnosu na rastojanja između čestica tečnih i čvrstih tela.
Temperatura je srazmerna srednjoj kinetičkoj energiji haotičnog kretanja čestica gasa.
Na ovaj način se definiše apsolutna temperatura. Označava se sa T i predstavlja jednu od sedam osnovnih fizičkih veličina.
Temperatura je nula kada je srednja kinetička energija čestica jednaka nuli. To je najniža vrednost temperature. Temperatura na kojoj prestaje kretanje čestica (kinetička energija i brzina su jednak nuli), zove se apsolutna nula.
Sredinom 19. veka teorijskim putem je ustanovljeno da je najniža moguća temperatura -273.150C (apsolutna nula). Temperatura koja se meri od apsolutne nule naziva se apsolutna temperatura ili Kelvinova temperatura. Jedinica temperature u međunarodnom sistemu jedinica je Kelvin (K). Podeok na Kelvinovoj skali je isti kao i podeok na Celzijusovoj skali, razlika je 273.15 stepeni između nulte tačke dve skale.
Bojl - Mariotov zakon
Za potpuno određivanje stanja idealnog gasa potrebno je istovremeno
znati veći broj parametara: količinu gasa, pritisak, zapreminu i
temperaturu. Mnoge procese u gasovima možemo posmatrati približno kao
procese u kojima se menjaju samo dve vrednosti pri čemu ostali imaju
stalne vrednosti, to su izoprocesi. Razlikujemo:
* izotermske (stalna temperatura),
* izohorske (stalna zapremina),
* izobarske (stalni pritisak).
Robert Bojl, engleski fizičar i hemičar irskog porekla, Njutnov savremenik i jedan od osnivača Britanske akademije nauka. Radio je u Oksfordu i eksperimentalno je utvrdio zavisnost pritiska gasa od njegove zapremine pri konstantnoj temperaturi. Nezavisno od njega istu zakonitost je ustanovio i francuski fizičar Mariot. Zbog ovoga ova zakonitost nosi njihova imena.
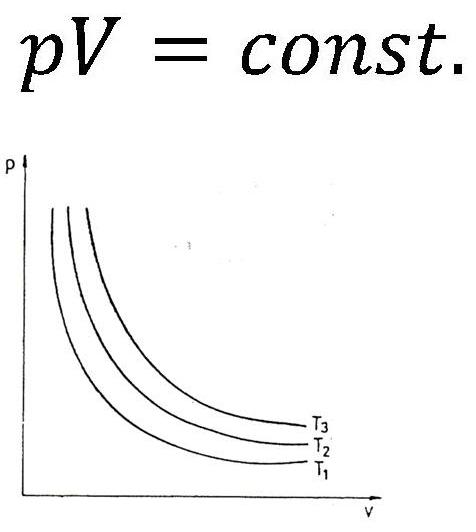
Za izotermske procese (to su procesi koji se odvijaju uz nepromenjivu temperaturu) važi:
Proizvod pritiska i zapremine određene količine gasa pri stalnoj temperaturi je konstantan.
Šarlov zakon
Zavisnost pritiska od temperature prvi je eksperimentalno proučavao francuski fizičar Šarl.
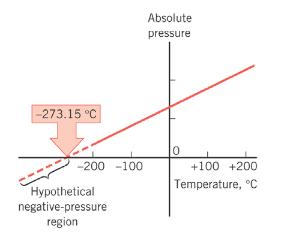
Povećanjem temperature povećava se i pritisak i ta zavisnost ima
linearni karakter (prava linija).
Prava koja prikazuje linearnu zavisnost pritiska od temperature pri
stalnoj zapremini naziva se izohora.
Gej-Lisakov zakon
Gej-Lisak francuski fizičar i hemičar, član Pariske akademije nauka. Eksperimentalno je ispitivao zavisnost zapremine gasa od temperature pri stalnom pritisku i ustanovio vezu među tim veličinama koja je nazvana Gej-Lisakov zakon. Dokazao je da koeficijent širenja ima istu vrednost za sve gasove i odredio njegovu vrednost: γ=1/273.15 0C.
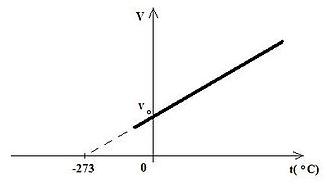
Zapremina određene količine gasa pri stalnom pritisku srazmerna je njegovoj apsolutnoj temperaturi.
Prava koja pokazuje zavisnost zapremine gasa od temperature pri stalnom pritisku naziva se izobara.
Video u vezi ovog poglavlja