2. razred - Fizika
4. Molekulske sile i agregatna stanja
Molekulske sile
Pri izučavanju supstance utvrđeno je da među česticama supstance (atomima ili molekulima) deluju molekulske sile. Te sile mogu da budu privlačne ili odbojne. Ukoliko tih sila ne bi bilo, tela bi se raspala ili bi se slila u jednu kompaktnu celinu. Primeri: odvajanje stakla od vlažne ravne površine, dve kapljice tečnosti na dovoljnoj blizini se spajaju u jednu kapljicu...
Molekulske sile su kratkog dometa (pri proučavanju gasova su zanemarljive).
U zavisnosti od rastojanja mogu biti:
- privlačne (rastojanja veća od prečnika čestice, odnosno rastojanja koja su veća od oko 10-10m) ili
- odbojne (rastojanja manja od prečnika čestice)
Objašnjenje za ove pojave proizilazi iz elektromagnetnog polja: elektroni jedne čestice privlače jezgro druge čestice kao i jezgro te druge čestice privlači elektrone prve čestice ukoliko su jezgra te dve čestice na malom rastojanju, ali malo većem od prečnika čestice. Ukoliko je rastojanje između čestica manje od prečnika čestice dva jezgra a i elektroni obe čestice će se odbijati.
Toplotno širenje tela
Pojava da se tela šire pri zagrevanju a skupljaju pri hlađenju je poznata. Slike dalekovoda su takođe poznate i najočigledniji primer ove pojave. Tokom ove pojave, pri preuzimanju toplote česticama se povećava unutrašnja energija i intenzitet njihovog "kretanja" se povećava i one "guraju" jedni druge i na taj način prave sebi više prostora za kretanje, odnosno telo se širi. Tokom širenja se povećava zapremina tela, odnosno telo se širi po svim pravcima.


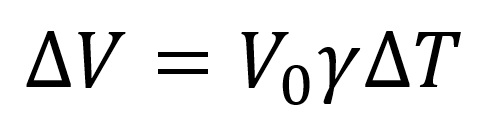
Pri čemu je:
- ΔV - povećanje zapremine zagrejanog tela
- V0 - zapremina tela pre zagrevanja
- γ - koeficijent širenja (za metale je veoma mali: (2-5)*10-5K-1)
- ΔT - temperaturna razlika
Struktura čvrstih tela - kristali
Tela koja imaju stalan oblik i zapreminu zovu se čvrstim telima. Čvrsta tela se dele na kristalna i amorfna tela.
U kristalnim telima čestice (atomi, joni ili molekuli) zauzimaju pravilan raspored u prostoru i time čine kristalnu strukturu. Između čestica koji čine kristal deluju relativno jake privlačne sile. Pošto je svaka čestica okružena drugim česticama sa svih strana, privlačne sile su uravnotežene i čestice se nalaze na određenim položajima. Pri pravljenju modela kristala ti položaji su predstavljeni čvorovima a međumolekularne sile se predstavljaju linijama između čvorova. Na taj način se dobija pravilna trodimenzionalna rešetka.
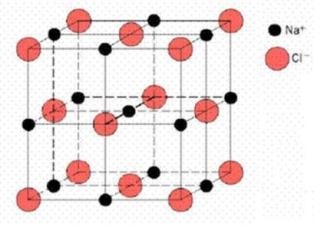

Osnovu kristalne rešetke predstavlja elementarna ćelija oblika paralelopipeda u čijim se uglovima nalaze čestice, koji su najmanji gradivni elementi kristala. Slaganjem tih osnovnih strukturalnih delova po sve tri ose u prostoru se dobija kristalna rešetka.
Osnovno svojstvo svake kristalne strukture je periodičnost u izgledu rešetke.
Na slici je prikazana struktura amorfnog i kristalnog tela:
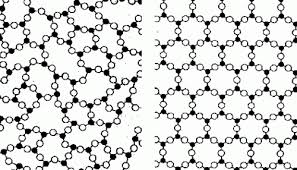
Po svojoj unutrašnjoj strukturi amorfna tela su bliska tečnostima, naprimer smole, stakla, plastična tela. Pri svojim mehaničkim svojstvima su bliska čvrstim telima. Njihove čestice osciluju oko ravnotežnog položaja ali nisu pravilno postavljena. Ova tela nemaju stalnu tačku topljenja.
Elastičnost čvrstih tela - Hukov zakon
Pod uticajem spoljašnjih sila čvrsta tela u manjoj ili većoj meri menjaju zapreminu i oblik, deformišu se. Ukoliko posle prestanka delovanja spoljašnjih sila i deformacije nestaju (tela se vraćaju u prvobitno stanje ili oblik) u pitanju su elastična tela. Ukoliko deformacije ostaju kao trajne, reč je o plastičnim telima. Stepen plastičnosti i elastičnosti zavisi od prirode tela i sile koja na njega deluje. Primeri: elastična tela su čelik i guma, dok su bakar i vosak plastična tela.
Deformacije tela se svode na dva osnovna oblika: istezanje i smicanje.
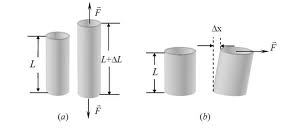
U praksi i tehnici je najprisutnije linijsko istezanje i sabijanje. Ono nastaje kada sila deluje samo duž jednog pravca u telu a deformacije u ostalim pravcima se zanemaruju. Δl - promena dužine tela zavisi od dimenzije tela, vrste materijala i intenziteta sile.
Hukov zakon:
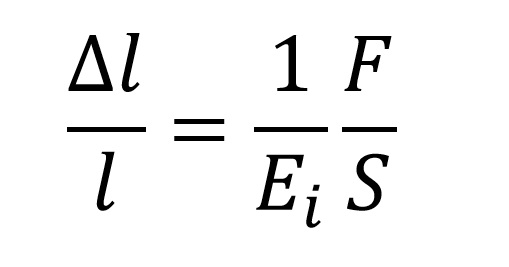
Pri čemu je:
- Δl/l - relativno istezanje
- Ei - Jangov moduo istezanja
- F - sila koja deluje na telo
- S - površina tela
Jangov moduo istezanja opisuje opiranje materijala elastičnoj linearnoj deformaciji (istezanju ili sabijanju). Vrednosti ovog parametra za metale je oko 1011 N/m2.
Drugi osnovni tip deformacija je smicanje. Hukov zakon za smicanje je veoma sličan zakonu za istezanje, njega karakterišu deformacije koje se ovde javljaju Δa/a = 1/Es * F/S, pri čemu je Δa/a relativno smicanje, dok je Es Jangov moduo smicanja, koji je za oko 1000 puta manji nego Ei za istu supstancu.
Materijali kod kojih ne postoji oblast elastičnih deformacija su vosak, glina, plastelin i tako dalje.
Svojstva realnih tečnosti
Tečnosti su po pojedinim osobinama nalik gasovima a po nekim osobinama su nalik čvrstim telima. Tečnosti kao i gasovi istiskuju tela koja se u njima nalaze (potisak), dok se pritisak prenosi podjednako na sve strane. Gasovi ispunjavaju ceo raspoloživi prostor i nemaju konstantan oblik ni zapreminu, tečnosti kao i čvrsta tela imaju zapreminu ali nemaju oblik.
Viskoznost
Viskoznost je postojanje unutrašnjeg trenja u tečnosti. Viskoznost usporava
proticanje tečnosti kao i kretanje kroz samu tečnost.
Gde je lakše trčati: na obali, u plitkoj vodi ili u dubokoj vodi?



Tečnost se kreće u slojevima (laminarno). Različiti slojevi se kreću
različitim brzinama. Primer je tok reke, na kojoj je najlakše kretanje
uzvodno uz obalu dok je kretanje nizvodno najbrže na sredini reke. Sloj
vode koji je direktno uz korito reke se usled velikog trenja ne kreće, dok
se naredni slojevi kreću sve većim brzinama sve do središnjeg dela toka
reke gde je tok najbrži.
Pri istoj brzini toka reke da li se čamac lakše kreće u dubokoj ili
plitkoj reci?
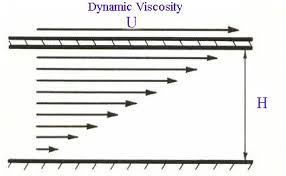
Ukoliko se posmatra kretanje vode kroz cev, u sredini cevi se voda (ili bilo koja tečnost) kreće najbrže, dok se udaljavanjem od sredine cevi brzina smanjuje.
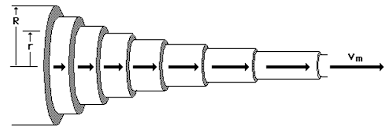
Njutnov zakon
Viskoznost - unutrašnji otpor tečnosti se može definisati i putem sile viskoznosti ukoliko je proticanje tečnosti laminarno (slojevito). Po ovom modelu tanki slojevi tečnosti klize jedni po drugome, pri tome čestice tečnosti iz jednog sloja ne prelaze u drugi sloj. Sila viskoznog trenja zavisi od vrste tečnosti.
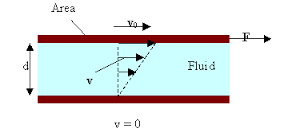
Primer putem kojeg se objašnjava Njutnov zakon viskoznosti su dve ploče na međusobnom rastojanju d, između kojih se nalazi tečnost koeficijenta viskoznosti η, pri čemu se donja ploča ne kreće dok se gornja ploča kreće brzinom v i ima površinu S.
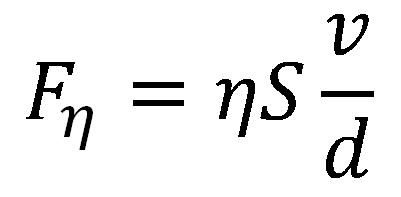
Kod vode je ta sila relativno slaba i voda brzo ističe iz posude, dok ista količina ulja će mnogo sporije da ističe iz posude.
Stoksov zakon
Sila viskoznosti tečnosti utiče na kretanje tela koja se u njoj nalaze (podmornica, ronilac). Naime, tečnost pruža otpor takvom kretanju, a taj otpor potiče od viskoznosti. Tanak sloj tečnosti "prilepljen" za tela kreće se zajedno sa telom i istom brzinom kao telo. Usled toga se pokreću i ostali slojevi tečnosti.
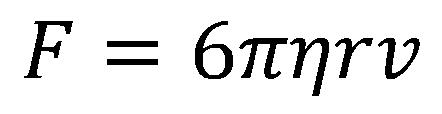
Ova formula predstavlja Stoksov zakon viskoznosti za telo sfernog oblika.
Površinski napon tečnosti
Površinski napon je uzrokovan privlačenjem između molekula tečnosti pomoću raznih međumolekulskih sila. U masi tečnosti, svaki molekul biva privlačen jednako u svim pravcima od strane susednih molekula tečnosti, što rezultuje rezultantom svih sila, koja je jednaka nuli. Na površini tečnosti, molekuli bivaju privlačeni prema dole od strane molekula koje se nalaze dublje u tečnosti, dok ih molekule u susednoj sredini (vakuum, vazduh ili nekoj drugoj tečnost) ne privlače tim intenzitetom. Molekuli na površini su pod uticajem privlačne molekularne sile, koja se uravnotežuje jedino preko otpora te tečnosti na pritisak, što znači da nema rezultantne sile privlačenja molekula sa površine od strane molekula u dubini tečnosti. Međutim, postoji sila koja umanjuje površinu, te zbog ovoga površina tečnosti dobija rastegnutu elastičnu membranu. Zbog ovoga se tečnost pomera sve dok ne dobije lokalno najmanju moguću površinu.
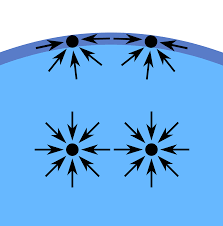




Drugi način objašnjenja je da molekul u kontaktu sa susednim molekulom ima niže energetsko stanje od slučaja kada nije u kontaktu sa susednim molekulom. Unutrašnji molekuli imaju susedne molekule sa svih strana. Granični molekuli imaju manji broj susednih molekula od unutrašnjih, te su, zbog toga, na višem energetskom stanju. Kako bi tečnost smanjila svoje energetsko stanje, ona mora smanjiti broj graničnih molekula, te, zbog toga, mora smanjiti svoju površinu. Kao rezultat smanjenja površine, površina će poprimiti najglađi mogući oblik (matematički dokaz da "glatki" oblici minimizuju površinu oslanja se na upotrebu Ojler–Lagranžove jednačine). Pošto bilo koje zakrivljenje na obliku površine rezultuje većom površinom, takođe će rezultovati i višom energijom. Na kraju će površina potiskivati svako zakrivljenje.
Fazni prelazi
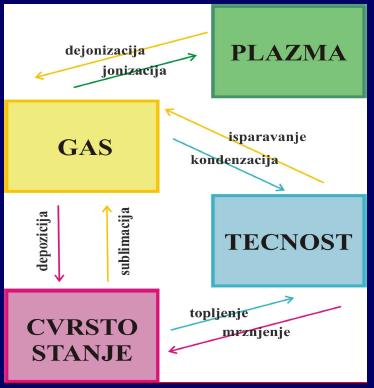
Sve supstance promenom temperature menjaju agregatna stanja. Čvrsta tela se pri zagrevanju tope, daljim povišenjem temperature isparavaju. Hlađenje tela dovodi do obrnutih procesa: pretvaranje pare u tečnost i tečnost u čvrstu supstancu. Postoje i slučajevi kada pri povećanju temperature čvrsta tela prelaze u paru, takav prelaz se naziva sublimacija.
Stanja supstance su agregatna stanja ili faze. Svaka supstanca ima tri osnovna agregatna stanja ili faze: čvrsto, tečno, gasovito. Kao četvrto agregatno stanje se spominje i plazma.
Promena agregatnog stanja supstance se naziva fazni prelaz.
Promena agregatnog stanja
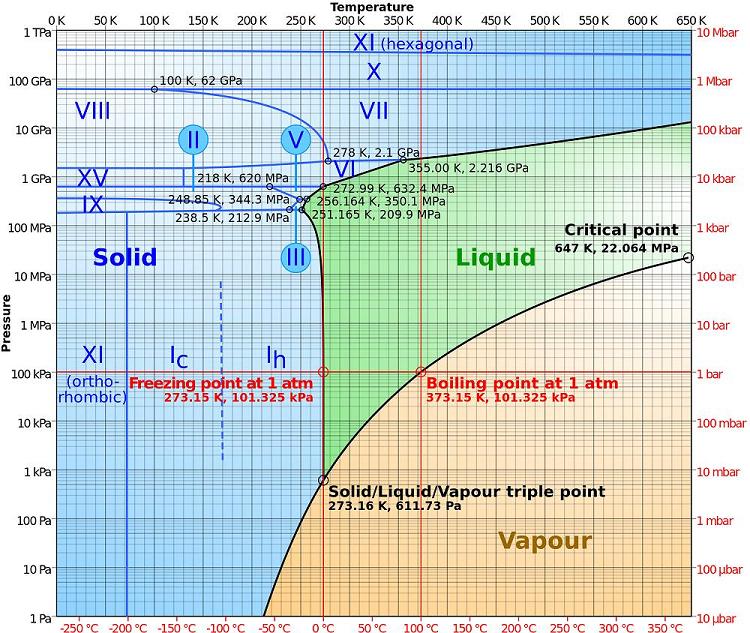
Prelazak supstance iz jedne faze u drugu pri zadatom pritisku vrši se uvek na strogo određenoj temperaturi. Pri atmosferskom pritisku led počinje da se topi na 00C i pri daljem zagrevanju temperatura ostaje neizmenjena dok se sav led ne pretvori u vodu. U toku tog procesa led i voda postoje istovremeno iako se nalaze u neposrednom kontaktu.
U odsustvu spoljnih uticaja (naprimer povećanja temperature) na temperaturi faznog prelaza dve faze zajedno postoje neograničeno dugo. Međutim višim ili nižim temperaturama od temperature faznog prelaza (pri datom pritisku), stabilno može postojati samo jedna od tih faza. Naprimer na temperaturama nižim od 00C, pri atmosferskom pritisku može postojati samo led a na višim od 00C samo voda.
Pod čvrstim stanjem supstance podrazumeva se samo kristalno stanje. Amorfno čvrsto telo se pri zagrevanju pretvara u tečnost putem postepenog omekšavanja, bez skokovitog prelaza. Zato amorfno čvrsto telo ne predstavlja posebnu fazu supstance, već specifičnu međufazu.
Za čvrstu supstancu kažemo da je amorfna ako njene čestice nisu uređene kao kod kristala. Primeri amorfnih tela su staklo, gelovi, tanki filmovi i nanostrukturni materijali. Amorfne supstance imaju određenu uređenost čestica samo na kraćim rastojanjima, ali ne postoji uređenost u celom prostoru. Kod kristalnih supstanci postoji pravilnost u prostoru u rasporedu čestica, i jačine veza između čestica su jednake, zbog toga pri zagrejavanju kristala veze između čestica se raskidaju naglo na određenoj temperaturi i kristali imaju tačno određenu temperaturu topljenja. S druge strane kod amorfnih supstanci rastojanja između čestica nisu jednake u svim delovima, zbog toga nisu jednake ni privlačne sile između pojedinih čestica i zbog toga pri zagrejavanju amorfnih supstanci ne postoji nagli prelaz iz čvrstog u tečno stanje na određenoj temperaturi, već pri zagrejavanju prvo omekšavaju, a zatim se tope u određenom temperaturnom intervalu. Čestice kod amorfnih supstanci su raspoređene haotično i u čvrstom stanju, s tim što je pokretljivost čestica u tečnom stanju je znatno veća. Zbog toga se stakla nekad nazivaju prehlađenim tečnostima.
Topljenje i očvršćavanje


Prelazak kristalnog tela u tečno stanje zagrevanjem zove se topljenje. Obrnuti prelazak supstance iz tečnog stanja u čvrsto (kristalno) sniženjem temperature zove se očvršćavanje. Temperature na kojima se ovi fazni prelazi dešavanju zovu se temperature (tačke) topljenja i očvršćavanja (kristalizacije) respektivno.
Pri zagrevanju tela, toplotno kretanje čestica (atoma ili molekula) postaje sve intenzivnije. Usled tog kretanja se povećava rastojanje između čestica koje obrazuju kristalnu rešetku, koja se usled kretanja kida i čestice se oslobađaju jakih veza, supstanca se topi. Za svaku supstancu se ovo dešava na određenoj temperaturi pri određenom pritisku.
Isparavanje i kondenzacija


Isparavanje je prelazak supstance iz tečnog u gasovito stanje (paru). Što je temperatura viša, isparavanje tečnosti je intenzivnije. Različite tečnosti na istoj temperaturi različito isparavaju. Etar ili benzin brže isparavaju nego voda i jestivo ulje. Etar ili benzin brže isparavaju od vode zato što između njihovih molekula deluju sile manjeg intenziteta nego između molekula vode.
Najintenzivniji prelaz u gasovito stanje se dešava prilikom ključanja. Tada molekuli iz cele zapremine tečnosti napuštaju tečnost - isparavaju. To se dešava na tačno određenoj temperaturi - tački ključanja i predstavlja fazni prelaz tečnost - gas.
Količina toplote koju je potrebno dovesti jednom kilogramu tečnosti da bi isparila pri konstantnoj temperaturi zove se specifična (latentna) količina toplote isparavanja.
Tačka (temperatura) ključanja zavisi od pritiska. Voda može da ključa i na 500C pri sniženom pritisku i pri 1200C pri povišenom pritisku, zbog toga postoji kriva isparavanja a ne samo jedna tačka.
Molekuli pare kao i svakog gasa vrše haotično (neuređeno) toplotno kretanje. Usled haotičnog kretanja čestice pare se sudaraju i deo tih čestica se nakon sudara vraća u tečnost iz koje je ispario, tako da se paralelno sa isparavanjem vrši i obrnut proces - kondenzacija.


Kondenzacija je prelazak supstance iz gasovitog u tečno stanje. Pri ovom procesu se gubi toplota (supstanca se hladi) ovaj fazni prelaz je suprotan isparavanju.
Zanimljivosti
Agregatna stanja i fazni prelazi