2. razred - Fizika
2. Termodinamika
Unutrašnja energija
Svako telo nezavisno da li je čvrsto, tečno ili gasovito, sastoji se od velikog broja čestica (atoma ili molekula).
Atom se sastoji od jezgra i omotača.
U jezgru se nalaze protoni i neutroni (zajedničko ime za protone i neutrone je nukleon).
U omotaču oko jezgra kruže elektroni po određenim putanjama.
Sve ove nabrojane čestice se kreću i uzajamno deluju jedne na druge:
* usled kretanja čestice poseduju kinetičku energiju,
* usled uzajamnog delovanja poseduju potencijalnu energiju.
Unutrašnja energija tela ili sistema je zbir energija svih čestica.
Izračunavanje unutrašnje energije tela ili sistema je veoma složeno, ali u pojedinim slučajevima može da ima jednostavan oblik kao kod molekula idealnog gasa.
Unutrašnju energiju idealnog gasa čini kinetička energija haotičnog translatornog kretanja njegovih čestica. Potencijalna energija idealnog gasa je zanemariva zbog velikih rastojanja među česticama.
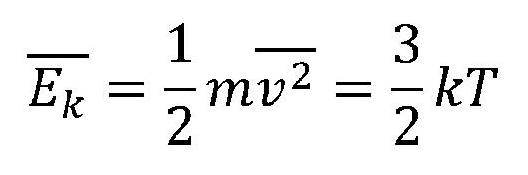
Video u vezi ovog poglavlja
Ukoliko idealan gas sadrži N čestica, njegova unutrašnja energija će biti:
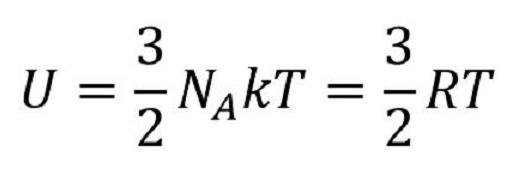
pri čemu je N=nNA a R=kNA,
NA=6.022.1023 [mol-1] - Avogadrov broj
k=1.38.10-23 [J/K] - Bolcmanova konstanta
R=8.313 [J/molK] - univerzalna gasna konstanta
n - broj molova
Jedinica mere unutrašnje energije je džul, kao i kod bilo kog drugog vida energije.
Promena unutrašnje energije
Svako telo (sistem) se sastoji od ogromnog broja čestica i samim time poseduje i veliku unutrašnju energiju. Promena unutrašnje energije idealnog sistema zavisi samo od razlike početne i krajnje temperature.
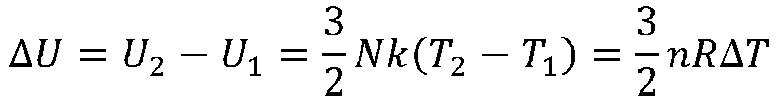
Promena unutrašnje energije tela može da se izvrši na dva načina: vršenjem rada ili toplotnom razmenom sa okolnim telima.
Postoje i slučajevi da se promena unutrašnje energije vrši istovremeno na oba načina.
Primer za promenu unutrašnje energije tela na osnovu rada: udar čekića o ekser, povećava se temperatura eksera i čekića; pumpanje vazduha u gumu bicikla dovodi do zagrevanja pumpe.
Osim vršenja rada unutrašnja energija tela se može promeniti i dodirom tela različitih temperatura. Hladnije telo će se grejati a toplije će se hladiti. Ovaj proces se odvija bez vršenja rada.
Količina toplote
Ukoliko su dva tela različitih temperatura u kontaktu između njih se odvija toplotna razmena. Toplotna razmena traje sve dok se temperature oba tela ne izjednače.
Količina toplote je uvedena da se odredi promena unutrašnje energije tela pri razmeni toplote.
Količina toplote je mera promene unutrašnje energije tela pri razmeni toplote.
Količina toplote koju neko telo predaje ili prima zavisi od mase tela, njegovih toplotnih svojstava i promene temperature.
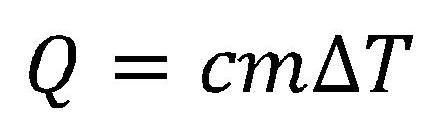
Pri čemu je:
- Q - količina toplote
- c - specifična toplotna kapacitivnost tela
- m - masa tela
- ΔT - promena temperature tela
Prvi princip termodinamike
Ovaj princip je poseban slučaj zakona održanja energije primenjen na
toplotne procese. Jedna od formulacija prvog principa termodinamike glasi:
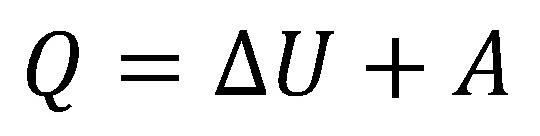
Količina toplote dovedena izolovanom sistemu, može jednim delom da
poveća njegovu unutrašnju energiju a drugi delom može da se pretvori u rad
tog sitema.
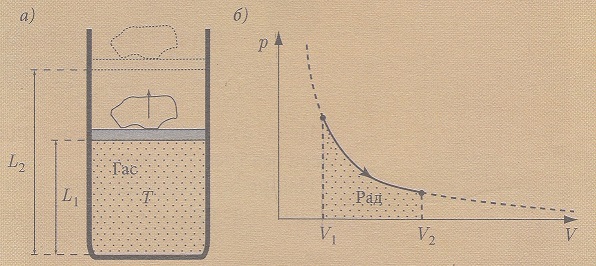
U sudu sa pokretnim klipom (trenje je zanemarivo) nalazi se idealan gas. Tom sistemu se dovodi toplota. Usled toplote se povećava unutrašnja energija i vrši se odgovarajući rad. Čestice idealnog gasa usled povećanja temperature se brže kreću i počinju da vrše pritisak na zidove suda a i na klip koji se podiže i zajedno sa klipom se podiže i kamen koji se nalazi na klipu. U ovom slučaju se povećava unutrašnja energija idealnog gasa (temperatura gasa je povećana), a i vrši se određeni rad (klip i kamen na njemu su podignuti, povećala se njihova potencijalna energija, odnosno određeni rad je takođe izvršen).
Kratka analiza ove formule glasi (šta se dešava ukoliko je jedna od ovih vrednosti nula):
a) Q = 0 - sistemu se ne dovodi toplota, niti se od njega oduzima, tada je A = -ΔU rad se vrši na račun unutrašnje energije sistema, koja se usled toga smanjuje.
b) ΔU = 0 - unutrašnja energija sistema se ne menja tada je Q = A - dovedena količina toplote se u potpunosti troši na vršenje rada. Ovo su izotermski procesi.
c) A = 0 - sistem ne vrši nikakav rad. Onda je Q = ΔU sva dovedena količina toplote se troši za povećanje unutrašnje energije sistema. Ovo su izohorski procesi.
Izoprocesi su:
* izotermski (stalna temperatura),
* izohorski (stalna zapremina),
* izobarski (stalni pritisak).
Na osnovu izloženog može se zaključiti da se ne može konstruisati mašina koja će raditi nasuprot ovom principu: nemoguće je kostruisati perpetuum mobile, mašinu koja radi bez da se za njen rad ne ulaže bilo kakav vid energije.
Rad gasa pri izobarskom procesu
Neka se idealni gas nalazi u cilindru sa klipom koji može da se pomera u oba smera bez trenja. Rad koji se vrši pri izobarskom širenju gasa, odnosno rad sile pritiska kojim gas deluje na pokretni klip je: F = p * S sila je jednaka proizvodu pritiska i površine klipa na koji deluju čestice gasa.
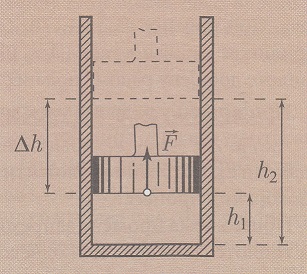
Delovanjem te sile klip će se pomeriti za rastojanje:
Δh = h2 - h1
U takvim uslovima rad sile pritiska pri širenju idealnog gasa je:
A = F * Δh = p * S * (h2 - h1)
Odnosno može se napisati:
A = p * ΔV
pri čemu je ΔV - promena zapremine gasa.
Prilikom širenja gasa se vrši pozitivan rad jer se smer sile kojom gas
deluje na klip poklapa sa smerom pomeranja klipa. U procesu širenja gas
predaje energiju spoljašnjim telima (u ovom slučaju klip, a preko njega
može i drugim telima).
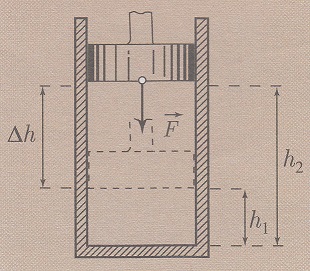
Prilikom sabijanja gasa V2 < V1 i zato je rad
negativan. Rad spoljašnje sile nad gasom se razlikuje od rada koji vrši
sila kojom gas deluje na klip (za ista pomeranja klipa) samo po predznaku.
Rad spoljašnje sile koja deluje na gas iznosi:
A’ = -A = - p * ΔV
Rad gasa pri izotermskom procesu
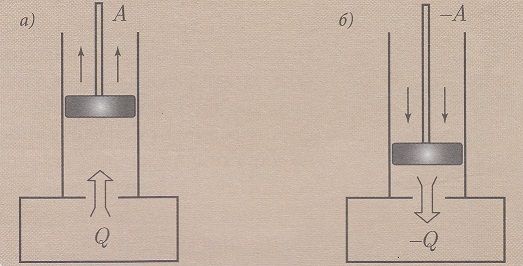
Izotermski proces je opisan Bojl-Mariotovim zakonom. Pri izotermskom procesu unutrašnja energija gasa se ne menja, pošto je temperatura konstantna.
ΔT = const te iz ovoga sledi da je ΔU = 0.
Uzevši ovo u obzir na osnovu prvog principa termodinamike sledi da je Q = A
Količina toplote koja se dovodi gasu u potpunosti se pretvara u rad koji vrši sila pritiska pri širenju tog gasa.
Na slici a) prikazan je smer predaje toplote sistemu pri izotermskom širenju gasa i izvršeni rad pri tom procesu.
Kod izotermskog sabijanja tog gasa smer je obrnut slika b).
Iz poslednje relacije se vidi da se znak količine toplote poklapa sa predznakom rada. Pri širenju gasa (A>0) sistem prima određenu količinu toplote (Q>0).
Prilikom sabijanja gasa (A<0) i (Q<0) sistem predaje (otpušta) količinu toplote dobijenu radom spoljnih sila okolnim telima telima (spoljnoj sredini).
Pri vršenju rada gas uvek menja zapreminu.
Toplotni kapacitet i specifičan toplotni kapacitet gasova
Za čvrsta i tečna tela važi da je zapremina tela (sistema) stalna u toku toplotne razmene. U takvim situacijama se rad ne vrši (A= 0). Za tečna i čvrsta tela se zapremine neznatno menjaju pri manjim promenama temperature. Kod gasova postoji:
- specifična toplotna kapacitivnost pri stalnoj zapremini
- specifična toplotna kapacitivnost pri stalnom pritisku.
Ove razlike se kod gasova ne mogu zanemariti.
Ukoliko se određena količina toplote dovodi gasu pri stalnoj zapremini, ta količina toplote ide na povećanje samo unutrašnje energije.
Ukoliko se određena količina toplote dovodi gasu pri stalnom pritisku, ta količina toplote se "troši" i na povećanje unutrašnje energije i na vršenje rada.
Molska toplotna kapacitivnost gasa pri stalnoj zapremini (CV) jednaka je količini toplote koju treba da primi ili otpusti jedan mol gasa da bi mu se temperatura promenila za jedan Kelvin pri stalnoj zapremini.
Molska toplotna kapacitivnost gasa pri stalnom pritisku (CP) jednaka je količini toplote koju treba da primi ili otpusti jedan mol gasa da bi mu se temperatura promenila za jedan Kelvin pri stalnom pritisku.
Odnos CP/CV se obično označava sa k ima različite vrednosti za jednoatomske, dvoatomske, troatomske, ... molekule.
Za jednoatomske molekule k = 1.67
Za dvoatomske molekule k = 1.40
Za tro i višeatomske molekule k = 1.33
------------------
CP = 5R/2
CV = 3R/2
CP - CV = R
Adijabatski proces
Procesi koji se odvijaju bez razmene toplote između gasa i okoline (spoljnih tela) zovu se adijabatski procesi.
Jedan način je da gas bude idealno toplotno izolovan, a drugi način je da se proces izvede tako brzo da ne dođe do toplotne razmene sa okolinom.
U praksi nema idealne toplotne izolacije a ni procesi ne mogu da se izvrše toliko brzo da ne dođe do toplotne razmene između gasa i okoline. Svi realni procesi se odvijaju manje ili više približno kao adijabatski.
Adijabatski karakter nekog procesa se izražava formulom Q = 0, na osnovu prvog principa termodinamike Q = ΔU + A sledi da je pri adijabatskim procesima: ΔU = -A ili A = -ΔU. Pri adijabatskom procesu rad i promena unutrašnje nergije imaju suprotne predznake. Pri adijabatskom širenju gas se hladi a pri sabijanju se gas zagreva.
Prema Bojl-Mariotovom zakonu pV = const.,
dok je pri adijabatskoj promeni pVk = const. pri čemu je k = CP/CV - Poasonov broj
Povratni i nepovratni termodinamički procesi
Za vršenje mehaničkog rada postoje prirodni energetski izvori (energija mišića ljudi i životinja, energija strujanja vazduha i vode).
Za potrebe savremenog društva (pogon automobila, brodova vozova, aviona) koriste se drugi izvori. Oni potencijalnu energiju molekula pretvaraju u kinetičku energiju (odnosno u unutrašnju energiju i toplotu).
Ovako dobijena kinetička energija se dalje može pretvoriti u neki drugi vid energije ali i ponovo u toplotu (odnosno unutrašnju energiju). Iz ovoga sledi zaključak da procesi u prirodi mogu biti povratni.
Iskustvo pokazuje da se samo deo energije pretvata u mehanički rad, te se stanje ne može vratiti u početno stanje zbog gubitka energije tokom procesa.
Svi termodinamički procesi su nepovratni sa energetskog stanovišta jer ne postoji idealna mašina koja bi radila bez gubitaka (npr. trenje ili savladavanje otpora vazduha). Kod motora sa unutrašnjim sagorevanjem se ovi gubici nadoknađuju potrošnjom goriva (benzina).
Reverzibilni procesi se drugim imenom zovu povratni procesi.
Ireverzibilni procesi se drugim imenom zovu nepovratni procesi.
Entropija
Ovaj pojam je u fiziku uveo nemački fizičar Rudolf Julius Emanuel Klauzijus prilikom razmatranja pojava i rešavanja problema u termodinamici.
Pretvaranje unutrašnje energije tela (sistema) u druge oblike energije pokazuje se boljim (vrši se sa manjim gubicima) ukoliko njegova temperatura viša u odnosu na temperaturu tela iz okoline. Sa druge strane praktično da nije moguće transformisati unutrašnju energiju tela (sistema) u druge oblike energije ako se njegova temperatura neznatno razlikuje od temperature okoline, posebno ukoliko je reč o niskim temperaturama.
Jedna od bitnih karakteristika svake toplotne pojave, procesa je količina toplote koja se razmeni između termodinamičkih sistema ili sistema i okoline.
Količina toplote je karakteristika toplotnog procesa a ne termodinamičkog stanja. Povećanje temperature sistema (tela) usled primanja određene količine toplote povećava haotično kretanje čestica, povećava se nered u sistemu. Stepen povećanja nereda ne zavisi samo od primljene količine toplote, nego i od toga na kojoj se temperaturi vrši taj proces. Na višoj temperaturi nered u kretanju čestica je veći, pa dodatno dovedena količina toplote ima manji efekat na neuređenje.
Ova činjenica je navela fizičare da uvedu novu veličinu kojom se izbegavaju navedeni nedostaci a definisana je pomoću količine toplote i temperature. To je redukovana količina toplote ili entropija:
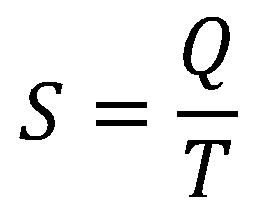
Količina toplote koja se predaje ili oduzima sistemu (telu) po jedinici temperature naziva se entropija tela.
Jedinica je džul po kelvinu J/K.
Entropija je kao i unutrašnja energija funkcija stanja sistema. Ona zavisi samo od parametara koje karakterišu stanje sistema. Praktično značenje ima samo promene entropije.
Svi realni termodinamički procesi su vezani za određene gubitke energije. Svi takvi procesi su u manjem ili većem stepenu nepovratni i karakteriše ih povećanje entropije.
Sve realne procese u izolovanom sistemu karakteriše povećanje entropije.
Entropija je težnja sistema da pređe u stanje veće neuređenosi, dakle entropija je merilo neuređenosti sistema. Najveća uređenost sistema je na apsolunoj nuli.
Drugi princip termodinamike
Iz iskustva je poznato da toplota spontano prelazi sa tela više temperature na telo niže temperature. Prvi princip termodinamike ne bi bio narušen ukoliko bi toplota prelazila sa tela niže temperature na telo više temperature, pod uslovom da ukupna energija izolovanog sistema ostaje nepromenjena. Praksa pokazuje da se takav proces spontano ne dešava.
Prvi princip termodinamike dozvoljava potpuno pretvaranje kinetičke energije u unutrašnju energiju (kao i unutrašnje u kinetičku).
Drugi princip termodinamike određuje smer toplotnih procesa.
Može da se definiše na više načina, jedna najjednostavnijih definicija drugog principa termodinamike:
Toplota spontano prelazi samo sa tela više temperature na telo niže temperature, obrnuto prelazak toplote sa hladnijeg tela na toplije ne može se vršiti samo od sebe (spontano).
Toplotne mašine
Današnji život je teško zamisliti bez toplotnih mašina. One služe za dobijanje električne energije, pokretanje velikog broja transportnih objekata.
Značajna je primena parnih turbina u termoelektranama za obrtanje rotora generatora. Parne turbine ugrađuju se i na nuklearnim elektranama, gde se za dobijanje visokotemperaturne pare koriste nuklearni procesi.
Savremeni transport upotrebljava sve tipove toplotnih motora. U automobilima, traktorima, kombajnima koriste se motori sa unutrašnjim sagorevanjem. U avijaciji se primenjuju gasne turbine. Reaktivni motori koji takođe rade na principu rada toplotnih mašina, koriste se u kosmičkim raketama.
Princip rada i energetski bilans toplotnog motora
Toplotni motori su uređaji u kojima se na račun unutrašnje energije dobija mehanička energija.
Svaka toplotna mašina osim što pretvara unutrašnju energiju u rad, vrši predaju jednog dela primljene toplote okolnim telima.
Svaka toplotna mašina se sastoji iz tri dela:
- radnog dela,
- grejača i
- hladnjaka.
U svojstvu hladnjaka se najčešće koristi atmosfera, vodena sredina a može i zemlja.
Kao radno telo obično se koristi gas ili para u zatvorenom sudu sa pokretnim klipom.
U procesu širenja, radno telo (gas ili para) prima neku količinu toplote od grejača (onog dela u kojem se na račun sagorevanja nafte, benzina ili nuklearnih reakcija) održava konstantno visoka temperatura. U procesu sabijanja radno telo (gas ili para) predaje neku količinu toplote hladnjaku odnosno telu koje ima nižu temperaturu od temperature grejača. Širenje gasa uzrokuje pomeranje klipa u cilindru motora. Pri širenju gasa njegov pritisak opada dok ne postane jednak spoljašnjem pritisku. Tada se širenje gasa zaustavlja i gas u cilindru prestaje da vrši rad. Nakon toga je neophodno putem sabijanja vratiti gas u početno stanje. Sabijanje gasa može samo da se vrši pod dejstvom spoljašnje sile. Posle toga se ponovo odvijaju procesi širenja i sabijanja gasova. U toplotnom motoru se vrše periodični procesi širenja i sabijanja gasa(pare).
Koeficijent korisnog dejstva
Termodinamički ciklus kao celina ima svoj energetski bilans. Koeficijent korisnog dejstva ciklusa je odnos korisnog i uloženog rada.
η = A/Q1 = (Q1-Q2)/Q1
Koeficijent korisnog dejstva je broj koji je veći od nule a manji od jedan. Broj je uvek manji od jedan pošto se u svakom procesu pojavljuju gubici.
Primeri orijentacionih stepena korisnog dejstva:
Parna mašina: 8%
Čovekovo telo: 25%
Benzinski motor: 25%
Dizel motor: 36%
Vodena turbina: 80%
Elektromotor: 85%
Transformator: 98%